Cell Reports Medicine|劉長梅/滕兆乾/王寧利團隊報道Lhx2促進(jìn)視網(wǎng)膜和視神經(jīng)損傷后的RGC存活和軸突再生
視網(wǎng)膜神經(jīng)節(jié)細(xì)胞(RGCs)的軸突形成視神經(jīng)���,將視覺信息從眼睛傳遞到大腦��。RGCs及其軸突的損傷或丟失是創(chuàng)傷和退行性疾?��。ㄈ缜喙庋郏┲幸曈X功能缺陷的主要原因。然而����,對于這些神經(jīng)退行性疾病的神經(jīng)損傷,目前還沒有有效的臨床治療方法����。2024年5月21日���,中國科學(xué)院動物研究所劉長梅/滕兆乾研究員、北京同仁醫(yī)院王寧利教授聯(lián)合在Cell Reports Medicine (IF 14.3)發(fā)表題為“Lhx2 promotes axon regeneration of adult retinal ganglion cells and rescues neurodegeneration in mouse models of glaucoma”的研究論文��。該研究揭示了Lhx2在促進(jìn)RGC存活和軸突再生中的關(guān)鍵作用����,為青光眼神經(jīng)退行性病變提供了一種有前景的神經(jīng)修復(fù)策略����。本研究所用AAV2-CAG-PLAP ����、 AAV2-CAG-CNTF病毒載體由維真生物助力提供。
研究結(jié)果
1����、Lhx2的過表達(dá)促進(jìn)ONC模型中RGCs的軸突再生
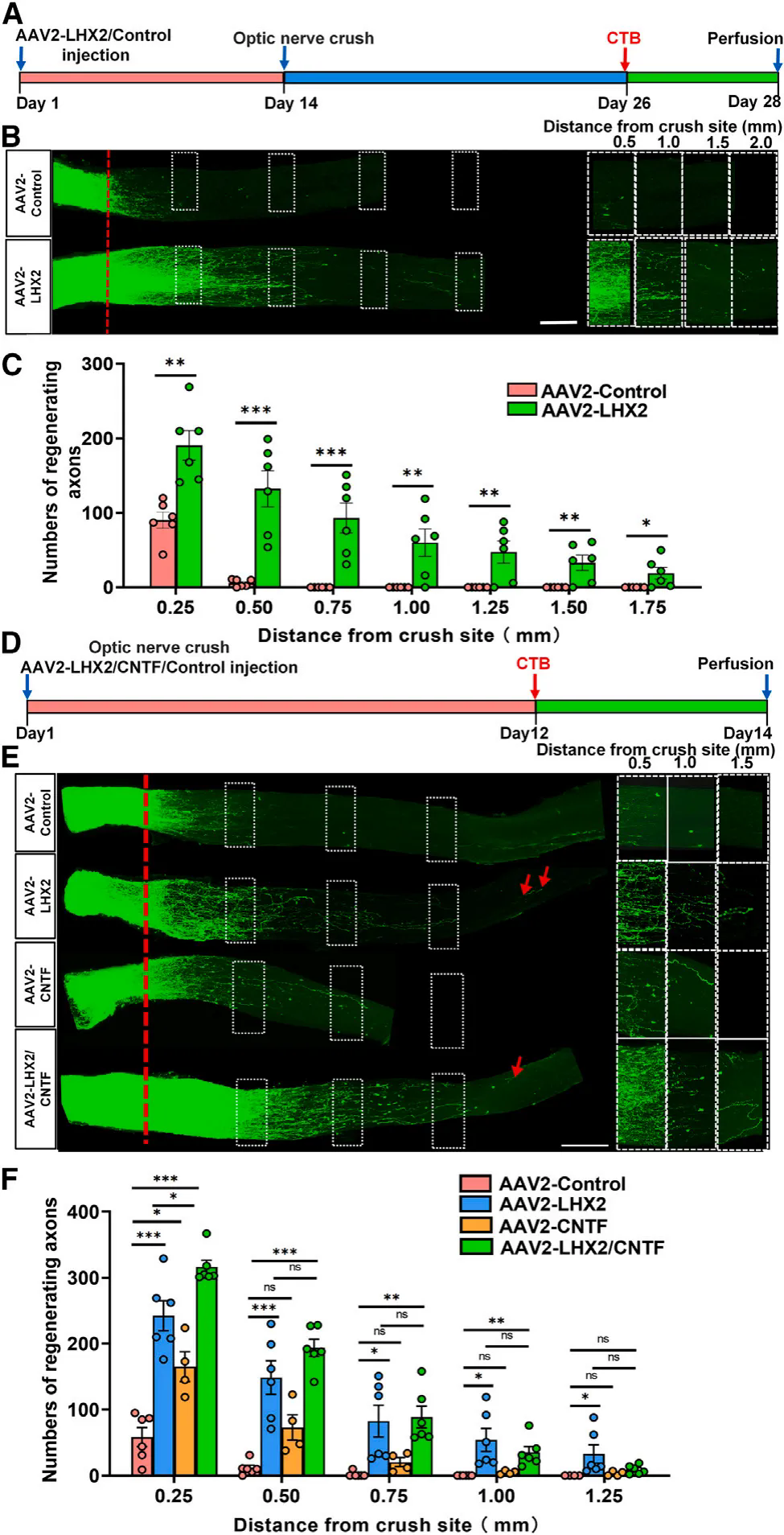
研究人員向小鼠玻璃體內(nèi)注射AAV2-LHX2及AAV2-CLAP(對照)以研究Lhx2在RGCs中的功能��,病毒注射兩周后進(jìn)行視神經(jīng)擠壓損傷���,結(jié)果顯示Lhx2的過表達(dá)顯著促進(jìn)了軸突再生。CNTF是一種強效神經(jīng)營養(yǎng)因子�,已知可保護視神經(jīng)損傷后RGC的存活并誘導(dǎo)軸突再生����,為了評估Lhx2和Cntf過表達(dá)是否具有協(xié)同作用,研究團隊進(jìn)行了AAV2-LHX2和AAV2-CNTF聯(lián)合注射���,分析發(fā)現(xiàn)Lhx2和Cntf的共表達(dá)顯著誘導(dǎo)了損傷后RGCs的軸突再生,在距離損傷部位0.25或0.5 mm處軸突再生數(shù)量是Cntf單獨治療的兩倍����;并且在距離損傷位置0.75�����、1和1.25 mm處���,單獨使用Lhx2治療的效果與Lhx2和Cntf組合相似�����。這些結(jié)果證明了Lhx2過表達(dá)在增強中樞神經(jīng)系統(tǒng)軸突再生方面的治療潛力���。進(jìn)一步研究表明Lhx2過表達(dá)在ONC、NMDA誘導(dǎo)的視網(wǎng)膜興奮性毒性模型和磁珠誘導(dǎo)性青光眼模型中具有保護RGC存活的潛力。
Lhx2促進(jìn)視神經(jīng)擠壓后RGCs軸突再生
2��、Lhx2介導(dǎo)的軸突再生和神經(jīng)元胞體存活效應(yīng)對RGCs具有特異性
基于上述結(jié)果,研究人員假設(shè)Lhx2過表達(dá)可能恢復(fù)NMDA介導(dǎo)的興奮性毒性損傷小鼠的視覺功能�����,因此通過視覺電生理學(xué)評估了NMDA注射小鼠RGCs的電信號活性��,結(jié)果證實Lhx2介導(dǎo)的RGC保護可以保持功能性視力��。研究表明Lhx2在RPCs中高表達(dá),在成年RGCs中表達(dá)水平非常低��;在成年期�����,Lhx2主要在Müller細(xì)胞和視網(wǎng)膜中的抑制性中間神經(jīng)元中表達(dá)���,因此研究團隊探索了Lhx2過表達(dá)誘導(dǎo)的軸突再生和RGC存活是否是RGC特異性的�。將AAV2-Flex-LHX2和AAV2-Flex EGFP注射至兩個Cre轉(zhuǎn)基因小鼠系,使LHX2分別在RGCs(Vglut2-Cre)或抑制性中間神經(jīng)元(Vgat-Cre)中選擇性表達(dá)�����。結(jié)果顯示����,單獨在RGCs中表達(dá)Lhx2可以顯著促進(jìn)軸突再生,但在抑制性中間神經(jīng)元中沒有�;在ONC模型或NMDA誘導(dǎo)的興奮性毒性模型中也觀察到類似的結(jié)果,Lhx2介導(dǎo)的軸突再生和細(xì)胞體存活效應(yīng)對RGCs具有特異性���。
Lhx2介導(dǎo)的軸突再生是RGCs特有的
3、Lhx2通過下調(diào)Sema3C促進(jìn)RGCs軸突再生
通過RNA-seq分析Lhx2過表達(dá)誘導(dǎo)的轉(zhuǎn)錄組變化�����,揭示了Lhx2在軸突再生過程中抑制重要神經(jīng)發(fā)育基因的功能��,并且Sema3C和Pmp22可能是Lhx2的直接下游靶標(biāo)��。已知Sema3C在軸突生長和導(dǎo)向中發(fā)揮重要作用,檢測發(fā)現(xiàn)Sema3C的表達(dá)在視神經(jīng)損傷后3天達(dá)到峰值�����,Lhx2過表達(dá)顯著下調(diào)其蛋白水平�,并且在RGCs中同時過表達(dá)AAV2-LHX2和AAV2-Sema3C后����,Lhx2介導(dǎo)的RGCs的軸突再生被Sema3C過表達(dá)中和��,表明ONC后Lhx2介導(dǎo)的RGCs的軸突再生需要Sema3C的抑制��;此外�,敲低Sema3C促進(jìn)了RGCs的軸突再生��。另一方面,Pmp22的過表達(dá)不能阻斷Lhx2誘導(dǎo)的RGCs的軸突再生��,表明Pmp22不是Lhx2的功能性下游靶標(biāo)�。RGC存活結(jié)果顯示���,在ONC和NMDA誘導(dǎo)的興奮性毒性模型中�,通過過表達(dá)Lhx2維持的RGC存活獨立于Sema3C。上述結(jié)果說明�����,Sema3C作為Lhx2的下游靶標(biāo)�����,主要參與軸突再生,而不是RGC的存活����。
Lhx2通過轉(zhuǎn)錄抑制Sema3C促進(jìn)RGCs的軸突再生
結(jié)論
本研究闡明了Lhx2的過表達(dá)促進(jìn)視網(wǎng)膜和視神經(jīng)損傷后的RGC存活和軸突再生��,并保持功能性視力,Sema3C作為Lhx2下游靶標(biāo)在促進(jìn)RGCs的軸突再生中發(fā)揮作用�����。研究結(jié)果揭示了Lhx2在治療神經(jīng)損傷和神經(jīng)退行性疾病中的巨大潛力����。