1. 維真助力
2. 研究背景
阿爾茨海默?��。ˋlzheimer’s disease �,AD)是一種由神經(jīng)元死亡而造成的神經(jīng)變性疾病——以進(jìn)行性記憶力減退和獲得性知識喪失��,直至日常生活活動能力完全喪失為特征,給社會和家庭帶來沉重負(fù)擔(dān)�,成為嚴(yán)重的社會和醫(yī)療衛(wèi)生問題���。阿爾茨海默病是繼心血管病、腦血管病和腫瘤之后����,威脅老年人健康的重要疾病��。目前�����,全球約有5000萬人罹患阿爾茲海默癥。預(yù)計到2050年,這個數(shù)字將增加至1.52 億�。當(dāng)前�,全球每年用于治療�、護(hù)理阿爾茲海默癥病人的費(fèi)用已經(jīng)達(dá)到1萬億美元,而這一數(shù)字將在2030年達(dá)到目前的兩倍�。
阿爾茨海默病的病因復(fù)雜��,目前主流觀點(diǎn)認(rèn)為是由β淀粉樣蛋白(Aβ)和微管相關(guān)蛋白Tau沉積造成神經(jīng)元大量死亡引發(fā)的��,1998年以來���,有100余種治療此病的藥物進(jìn)行臨床試驗,但僅有6種針對此病癥的藥物獲得FDA的批準(zhǔn)上市����,而且近年來世界各大制藥公司針對Aβ或Tau蛋白開發(fā)的藥物均遭到了不同程度的失敗����,這給人類對于AD的攻克埋上了一層巨大的陰影����。
線粒體功能障礙是AD的一個基本病理特征�,在散發(fā)性和家族性AD病例以及AD動物模型中����,均被發(fā)現(xiàn)有受損的神經(jīng)元線粒體的積累����。功能受損的線粒體會觸發(fā)能量應(yīng)激�,從而促進(jìn)Aβ寡聚化和Tau過度磷酸化�����。線粒體合成調(diào)節(jié)因子PGC-1α的表達(dá)變化以及線粒體功能失調(diào)導(dǎo)致的鈣穩(wěn)態(tài)失衡都已被證實(shí)與AD的發(fā)生有關(guān)。新的研究表明���,AD患者的腦細(xì)胞中線粒體自噬受到損害,能造成大量損傷性線粒體積累�,導(dǎo)致突觸功能障礙和認(rèn)知功能的下降��。因此��,保障AD患者神經(jīng)細(xì)胞中線粒體自噬的正常進(jìn)行至關(guān)重要���,而找到一種誘導(dǎo)線粒體自噬的藥物靶點(diǎn)則是重中之重。
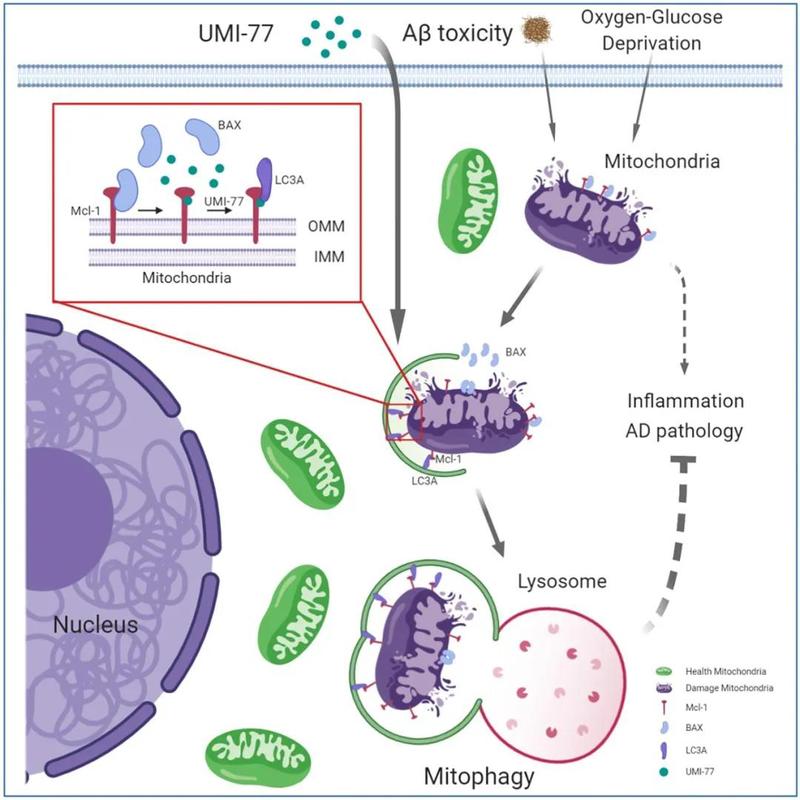
近期���,浙江大學(xué)基礎(chǔ)醫(yī)學(xué)院夏宏光教授團(tuán)隊在《Nature communications 》(IF=12.121)上在線發(fā)表了一篇關(guān)于阿爾茨海默病的最新研究成果—Pharmacological targeting of MCL-1 promotes mitophagy and improves disease pathologies in an Alzheimer’s disease mouse model。該研究首次揭示了抗凋亡蛋白MCL-1作為線粒體自噬受體蛋白介導(dǎo)線粒體自噬的新機(jī)制����,MCL-1的特異性抑制劑UMI-77可以在AD模型小鼠中顯著緩解阿爾茨海默病的病理特征,改善小鼠認(rèn)知���;本研究提出靶向MCL-1蛋白誘導(dǎo)線粒體自噬是一種有巨大前景的治療阿爾茨海默癥的策略。
UMI-77作用機(jī)制示意圖
3. 研究成果
首先,研究人員通過利用熒光蛋白Keima構(gòu)建敏感的線粒體自噬定量檢測方法����,對穩(wěn)定表達(dá)mt-Keima(Keima蛋白具有在酸性和中性pH中熒光信號不同的特性���,定位于線粒體中的Keima(mt-Keima)可顯示通過自噬途徑進(jìn)入溶酶體中的線粒體,直觀地反映線粒體自噬程度)的HEK293T細(xì)胞系和一個包含2024個FDA批準(zhǔn)的藥物或候選藥物庫進(jìn)行小分子化合物高通量篩選���,找到了一種可以安全有效誘導(dǎo)線粒體自噬的小分子化合物——UMI-77�,一種Bcl-2家族抑制劑。
研究表明���,UMI-77是抗凋亡蛋白MCL-1的特異性抑制劑����,能阻斷MCL-1和Bax/Bak之間的相互作用�����,從而允許Bax/Bak誘導(dǎo)細(xì)胞凋亡����。研究者通過測定線粒體的去極化及自噬水平����,發(fā)現(xiàn)與CCCP(氧化磷酸化抑制劑��,影響線粒體的蛋白合成)相比,UMI-77在亞致死劑量下不會誘導(dǎo)HEK293T和HeLa細(xì)胞的線粒體損傷����;在HEK293T-mt-Keima中����,UMI-77+CCCP聯(lián)合使用明顯增強(qiáng)了線粒體的自噬水平��,表明UMI-77不會造成線粒體損傷����,且能夠促進(jìn)線粒體自噬,且能增強(qiáng)CCCP誘導(dǎo)的線粒體損傷引發(fā)的線粒體自噬�����。HEK293T-mt-Keima細(xì)胞的活細(xì)胞成像實(shí)驗、透射電子顯微鏡(TEM)觀察及western bloting 實(shí)驗也證實(shí)了UMI-77的促線粒體自噬作用�。
為排除凋亡誘導(dǎo)劑對線粒體自噬可能的影響,研究者又做了評估實(shí)驗�。結(jié)果發(fā)現(xiàn)����,藥物庫中大多數(shù)誘導(dǎo)細(xì)胞凋亡的藥物及pan-caspase抑制劑Z-VAD-fmk(可阻斷細(xì)胞凋亡)不會影響UMI-77的促線粒體自噬作用�,這表明UMI-77誘導(dǎo)的線粒體自噬�����,不依賴于凋亡誘導(dǎo)�,且UMI-77在亞致死劑量下不會誘導(dǎo)細(xì)胞凋亡。與此同時���,UMI-77處理后��,巨自噬標(biāo)記物p62和其他細(xì)胞器標(biāo)記物的表達(dá)水平并沒有下降,這表明UMI-77可特異性誘導(dǎo)線粒體自噬�,不影響非選擇性自噬。
圖1. UMI-77可特異性誘導(dǎo)線粒體自噬
既然UMI-77能誘導(dǎo)線粒體自噬���,MCL-1又是UMI-77的靶點(diǎn)����,那么MCL-1是否參與了UMI-77誘導(dǎo)的線粒體自噬的過程呢���?研究者對此進(jìn)行了探索,發(fā)現(xiàn)在HEK293T和HeLa細(xì)胞中敲除MCL-1基因后減緩了UMI-77誘導(dǎo)的線粒體蛋白Tom20和Tim23的降解��,抑制了UMI-77誘導(dǎo)的線粒體自噬水平�����,這說明MCL-1在UMI-77誘導(dǎo)的線粒體自噬激活中是必須的��。
此前已有研究證明,細(xì)胞自噬受體如FUNDC1和FKBP8的過表達(dá)能促進(jìn)細(xì)胞自噬�,那么MCL-1在線粒體自噬中是否也是扮演自噬受體的角色����?為了探究其在自噬中所起的作用,研究者建立強(qiáng)力霉素Dox誘導(dǎo)的MCL-1過表達(dá)的HEK293T穩(wěn)定細(xì)胞系(HEK293T- MF2)���,值得注意的是�����,HEK293T- MF2中線粒體標(biāo)志物Tim23的表達(dá)水平下降,線粒體變小��、片段化�����,而且線粒體和溶酶體出現(xiàn)了共定位。透射電鏡分析也證實(shí)了MCL-1的過表達(dá)促進(jìn)了線粒體自噬�。綜上結(jié)果表明,MCL-1在線粒體自噬中發(fā)揮關(guān)鍵作用�。
圖2. MCL-1促進(jìn)線粒體自噬
研究者對MCL-1在線粒體自噬中是否扮演自噬受體的角色繼續(xù)展開研究��,并推測UMI-77誘導(dǎo)Bax/Bak中MCL-1釋放后能MCL-1能與LC3發(fā)生相互作用����,從而促進(jìn)線粒體自噬���。研究發(fā)現(xiàn)MCL-1在其C端有三個“LC3-相互作用區(qū)(LIR)”基序����,其中前兩個基序LIR261-264和LIR318-321位于胞質(zhì)區(qū)���,并且LIR261-264具有很強(qiáng)的保守性���,這提示它是有一定功能的���。
研究人員首先驗證了UMI-77是否能誘導(dǎo)MCL-1和LC3發(fā)生相互作用,通過免疫共沉淀試驗發(fā)現(xiàn)��,經(jīng)UMI-77處理后���,LC3A與MCL-1的相互作用增強(qiáng),而Bax與MCL-1的相互作用隨之減弱�����;在UMI-77的作用下,MCL-1還與其他Atg8家族蛋白相互作用����。此外�����,pull-down實(shí)驗也顯示MCL-1能直接與LC3A結(jié)合���。隨后�����,研究者又生成了一系列MCL-1 LIR261-264和LIR318 - 321基序的突變體,結(jié)果顯示MCL-1 LIR261-264基序突變后減弱了MCL-1與LC3A的相互作用�。
接下來����,研究者對UMI-77是否能增強(qiáng)內(nèi)源性MCL-1和LC3A的相互作用展開了相關(guān)研究:結(jié)果與我們預(yù)期一致��,發(fā)現(xiàn)用UMI-77處理后���,Duolink®PLA結(jié)果顯示,在線粒體上能觀察到內(nèi)源性MCL-1和LC3A相互作用的增強(qiáng)�,而未用UMI-77處理時這種相互作用也能觀察到����,反映了基礎(chǔ)內(nèi)源自噬的水平��。這個結(jié)果進(jìn)一步表明MCL-1是一個重要的線粒體自噬受體����。
最后�,作者又驗證了MCL-1和LC3A的相互作用是否能在UMI-77介導(dǎo)的線粒體自噬激活中起作用。結(jié)果顯示����,敲除MCL-1后��,HEK293T-mt-Keima和SH-SY5Y細(xì)胞中UMI-77介導(dǎo)的線粒體自噬水平降低���,而補(bǔ)充MCL-1/LIR318-321突變體MCL-1的表達(dá)可逆轉(zhuǎn)此現(xiàn)象���。
綜上所述�,MCL-1是一個線粒體自噬受體���,它通過其LIR261-264基序與LC3A直接作用�,并且這種相互作用能被UMI-77增強(qiáng)進(jìn)而導(dǎo)致線粒體自噬水平的增強(qiáng)��。此外��,MCL-1和LC3A之間的相互作用是UMI-77介導(dǎo)線粒體自噬激活的關(guān)鍵��。
圖3. MIC-1和LC3A的相互作用是UMI -77誘導(dǎo)線粒體自噬所必需的
隨后,作者研究了其他線粒體自噬受體蛋白是否在UMI-77誘導(dǎo)的線粒體自噬或MCL-1-LC3A相互作用的誘導(dǎo)中發(fā)揮作用���。作者以野生型HeLa細(xì)胞和四基因敲除的突變體HeLa細(xì)胞(敲除線粒體自噬受體NDP52��、p62�����、NBR1和TAX1BP1)為研究對象進(jìn)行研究,發(fā)現(xiàn)UMI-77能顯著增強(qiáng)MCL-1和LC3A之間的相互作用��,線粒體標(biāo)記蛋白Cox II和Tim23的表達(dá)水平也均呈現(xiàn)時間依賴性的降低����,此外�����,線粒體自噬受體(FUNDC1, BNIP3和NIX)也被證明不參與UMI-77誘導(dǎo)的線粒體自噬,表明UMI-77誘導(dǎo)的線粒體自噬與這些線粒體自噬受體蛋白無關(guān)����。
鑒于UMI-77阻斷了MCL-1與Bax的相互作用����,研究者隨后分析了Bax在UMI-77誘導(dǎo)的線粒體自噬中的作用�����,令人驚訝的是����,敲低Bax后UMI-77誘導(dǎo)的線粒體自噬水平增強(qiáng),說明Bax不參與UMI-77誘導(dǎo)的線粒體自噬�。另外兩種MCL-1相互作用蛋白Beclin1和Parkin也先后被排除參與UMI-77介導(dǎo)線粒體自噬激活的可能性�����。相反��,在HEK293T-mt-Keima細(xì)胞或MEF細(xì)胞中敲除ATG5后抑制了Tom20和Tim23降解����,說明ATG5是UMI-77誘導(dǎo)線粒體自噬必需的��。
綜上結(jié)果表明��,UMI-77誘導(dǎo)的線粒體自噬是通過ATG5自噬通路介導(dǎo)的����,不依賴于線粒體自噬受體蛋白NBR1���、TAX1BP1���、p62、NDP52�����、FUNDC1����、BNIP3、NIX以及MCL-1相互作用蛋白Bax�、Beclin1和Parkin��。
圖4. UMI-77以ATG5依賴的方式誘導(dǎo)線粒體自噬
接著��,研究者又研究了MCL-1作為線粒體自噬受體的生理功能����。研究表明,OGD(氧-糖剝奪)或OGD/再灌注會損傷線粒體����,并通過線粒體自噬誘導(dǎo)清除受損線粒體。mt-Keima實(shí)驗結(jié)果顯示��,敲除MCL-1后OGD誘導(dǎo)的線粒體自噬水平顯著降低�����,線粒體標(biāo)記蛋白Cox II和Tim23的特異性降解也被抑制,說明MCL-1對OGD誘導(dǎo)的線粒體自噬是必需的�����。
已有研究證明MCL-1可調(diào)節(jié)線粒體的碎片化��,因此研究人員試圖了解MCL-1在OGD誘導(dǎo)的線粒體自噬中的作用����。免疫熒光顯微鏡觀察到OGD處理后HEK293T細(xì)胞線粒體碎裂�����,而敲除MCL-1改變了這些形態(tài)學(xué)變化��,表明MCL-1在OGD誘導(dǎo)的線粒體碎片化中起著關(guān)鍵作用��,并且MCL-1 LIR261-264基序僅參與線粒體自噬,而不參與MCL-1的線粒體碎片化調(diào)節(jié)作用。同樣地����,OGD也增強(qiáng)了MCL-1與LC3A的相互作用,降低了其與Bax的相互作用���,再次證明MCL-1是一種線粒體自噬激活的受體�����。
圖5. MCL-1是OGD誘導(dǎo)的線粒體自噬所必需的
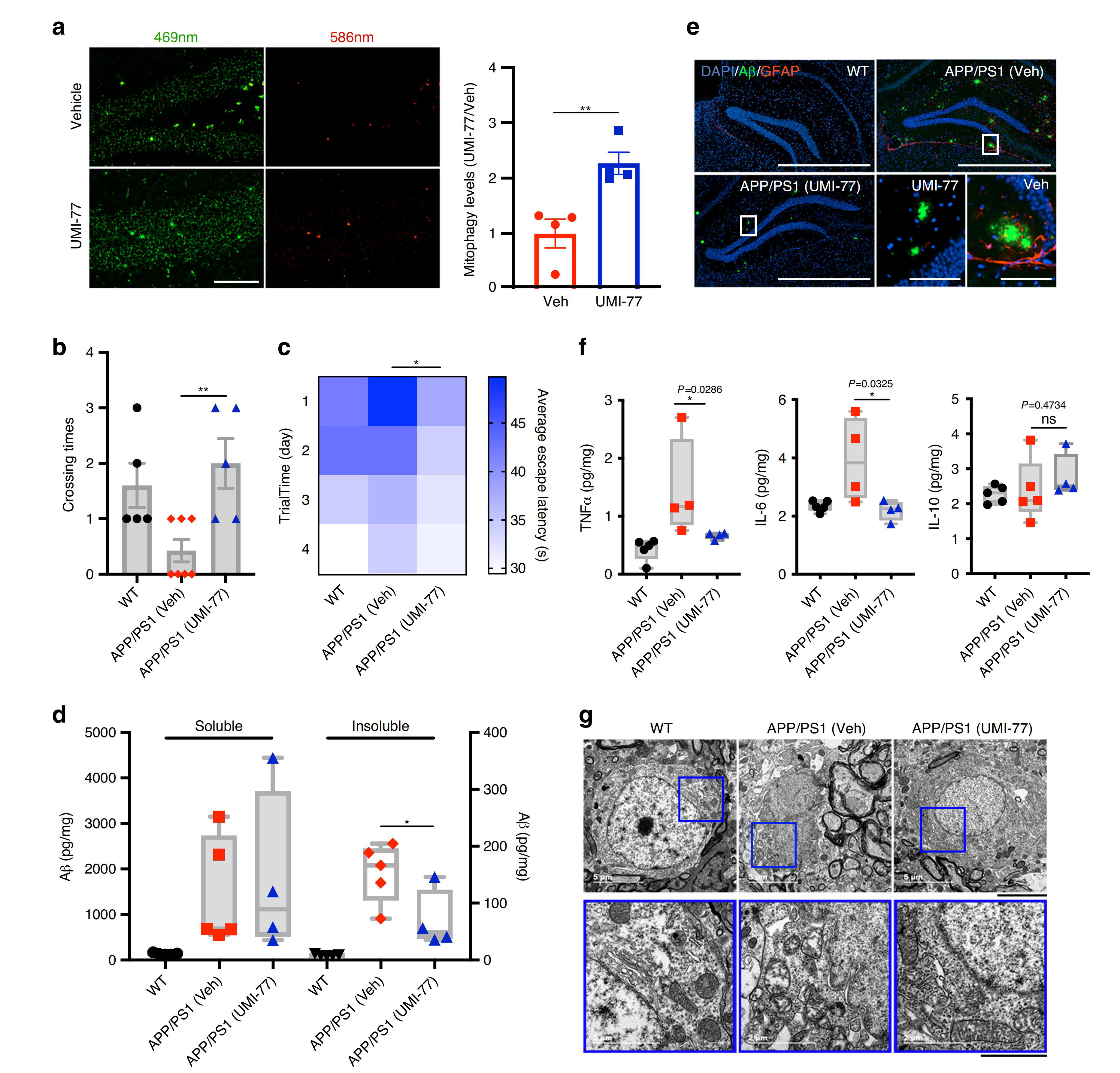
接著�����,研究人員探究了UMI-77誘導(dǎo)的線粒體自噬對AD模型APP/PS1小鼠疾病病理和行為表型的影響。對4月齡的小鼠腹腔注射10 mg/kg劑量的UMI-77���,共持續(xù)4個月。通過Morris水迷宮測試發(fā)現(xiàn)UMI-77治療明顯改善了APP/PS1小鼠的學(xué)習(xí)和記憶能力����,且能有效降低小鼠腦內(nèi)不溶性Aβ1-42的水平��。同樣�,免疫熒光結(jié)果也顯示UMI-77治療后海馬區(qū)細(xì)胞外Aβ斑塊明顯縮小,星形膠質(zhì)細(xì)胞的激活也受到抑制����。此外���,UMI-77也降低了APP/PS1小鼠的神經(jīng)炎癥水平,表現(xiàn)為炎癥細(xì)胞因子(TNFα和IL-6)水平顯著降低���。重要的是,UMI-77顯著恢復(fù)了神經(jīng)元的線粒體形態(tài)�����,這一研究結(jié)果與在APP/PS1小鼠中觀察到的通過UMI-77可以誘導(dǎo)線粒體自噬從而清楚受損線粒體相一致����。這些結(jié)果均表明UMI-77是一種治療AD的有效藥物����。
圖6. UMI-77是一種治療AD的有效藥物
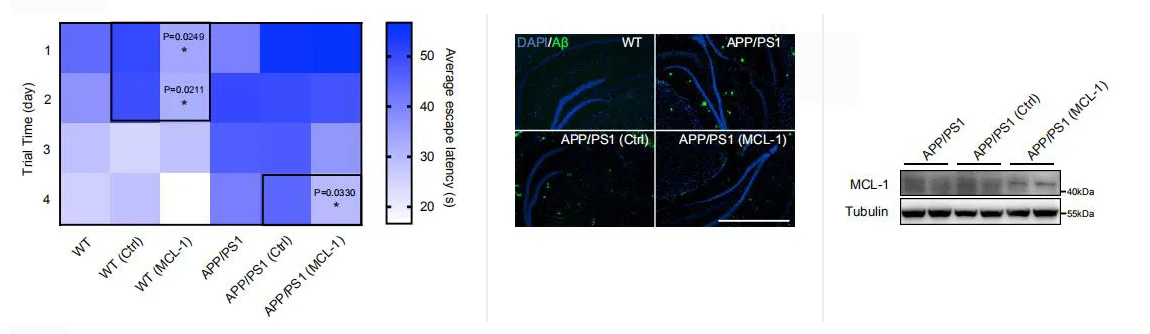
最后����,研究人員評估了MCL-1介導(dǎo)的線粒體自噬對APP/PS1小鼠行為表型的影響��。將AAV-MCL-1過表達(dá)載體注射小鼠的海馬區(qū)����,MCL-1的過表達(dá)顯著改善了APP/PS1小鼠的認(rèn)知功能,并減少了海馬區(qū)細(xì)胞外的Aβ斑塊�����。令人驚訝的是��,MCL-1的過表達(dá)也提高了野生型小鼠的學(xué)習(xí)和記憶能力�,表明MCL-1在神經(jīng)元中有非常重要的作用����。
綜上所述�����,MCL-1是一種新的線粒體自噬受體蛋白���,是治療阿爾茨海默癥的新藥物靶點(diǎn);UMI-77可以通過釋放游離的MCL-1蛋白誘導(dǎo)線粒體自噬��,顯著恢復(fù)APP/PS1 AD小鼠模型的認(rèn)知功能缺損��,減輕炎癥反應(yīng)和Aβ斑塊引起的病理效應(yīng)���,促進(jìn)受損線粒體的清除?��?偠灾?���,誘導(dǎo)線粒體自噬是治療阿爾茨海默癥的有效策略����。