病毒包裝-AAV注射肺部
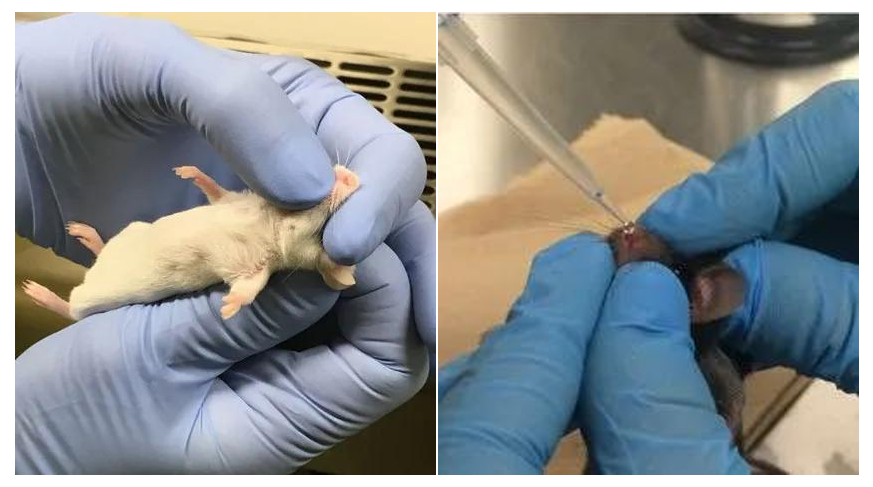
『病毒包裝-AAV感染肺部』- 鼻內(nèi)滴注法
鼻內(nèi)滴注法是一種直接的AAV感染法��,操作簡單且對設(shè)備要求低�����,對新手實驗員也同樣適用��。缺點是AAV顆粒容易沉積在上呼吸道(鼻道���、鼻竇和咽)和胃腸道,如果需要有效地感染到下呼吸道�����,則可能需要更大劑量的AAV才能實現(xiàn)。
圖1. 鼻內(nèi)滴注AAV(兩種操作手法)
(van Lieshout., et al. Methods Mol Biol, 2019.)( Santry, L.A., et al.BMC Biotechnol, 2017.)
鼻內(nèi)滴注AAV-操作步驟:
(1)腹腔注射氯胺酮和甲苯噻嗪將小鼠麻醉��;
注意:為了保持小鼠穩(wěn)定的呼吸頻率��,不應(yīng)過度麻醉�。
(2)甲按圖1所示兩種方法將小鼠控制好,防止其用嘴呼吸�;
(3)乙緩慢滴一滴AAV懸液于小鼠鼻孔內(nèi)壁,待液體被吸入后再滴下一滴����,重復(fù)此操作至40μL AAV懸液全部滴完;
(4)使小鼠保持上述姿勢約30~60s�����,以便AAV懸液充分進入下呼吸道��;
(5)待小鼠在籠中恢復(fù)10min后���,重復(fù)上述操作���,再次給藥40μL(每只小鼠共給藥80μL);
(6)將小鼠放回籠中直至完全清醒�����。
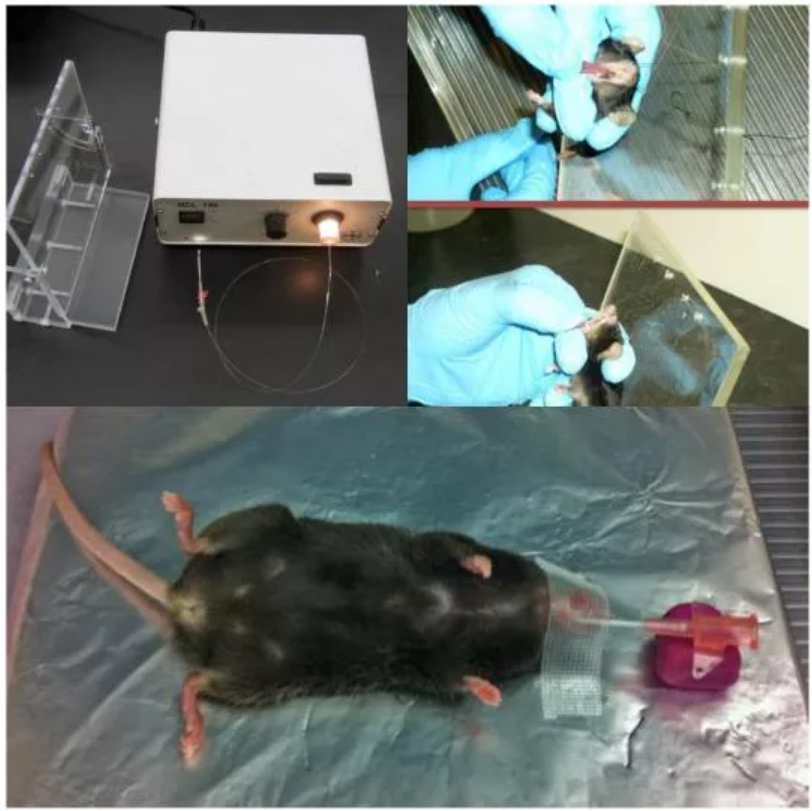
『病毒包裝-AAV感染肺部』- 氣管插管術(shù)
口腔氣管插管術(shù)能夠?qū)⒉《据d體直接灌輸入肺中,卻沒有外科手術(shù)的風(fēng)險�����,并且避免了上呼吸道的病毒顆粒的損失���。由于幾乎所有AAV病毒顆粒都會到達肺內(nèi),所以要嚴(yán)格控制AAV的使用量���。同時�����,與鼻內(nèi)滴注法相比����,口腔氣管插管術(shù)需要一些特殊設(shè)備���,操作起來也稍有難度��。
圖2. 氣管內(nèi)注射AAV (van Lieshout., et al. Methods Mol Biol, 2019. )
操作步驟:
(1)腹腔注射氯胺酮和甲苯噻嗪將小鼠麻醉�����;
注意:動物必須處于足夠深的麻醉狀態(tài)以防止運動或?qū)d體的反應(yīng)而打噴嚏或咳嗽����;
(2)將小鼠放在垂直支架上,將門牙環(huán)置于小鼠上門牙上�,讓老鼠的腹部面向自己;
(3)輕輕地把小鼠舌頭拉出來���,并用拇指和食指按住�����,中指放在小鼠頸部和塑料支架之間��;
(4)用食指����、拇指在小鼠舌上牽引令其嘴張開����,使插管路徑伸直,并用中指在頸后調(diào)整頭部角度�;
(5)利用光纖作為光源和引導(dǎo)者����,推動它通過可視聲帶(如果看不到聲帶��,用中指作支撐����,輕輕用力拉舌);
(6)光纖插入后����,同時將導(dǎo)管向前推進約5mm,然后勿移動導(dǎo)管��,取出光纖����;
(7)使小鼠平躺��,用膠帶將導(dǎo)管固定在小鼠嘴部防止其移動��,另一端用橡皮泥支撐�����;
(8)用注射器通過導(dǎo)管輸入80μL AAV; 注意:在抽取80μL載體之前����,吸取約100μL的空氣至移液管尖,以防止載體的丟失��,并促進載體深入肺部����;
(9)等待5min,使AAV充分進入下呼吸道��;
(10)把導(dǎo)管移出��,將小鼠輕輕從工作臺拿下�����,并將頭部和胸部用折疊的紙巾小幅度墊高�����,以保證小鼠順暢的呼吸�;
(11)將小鼠放回籠中直至完全清醒。
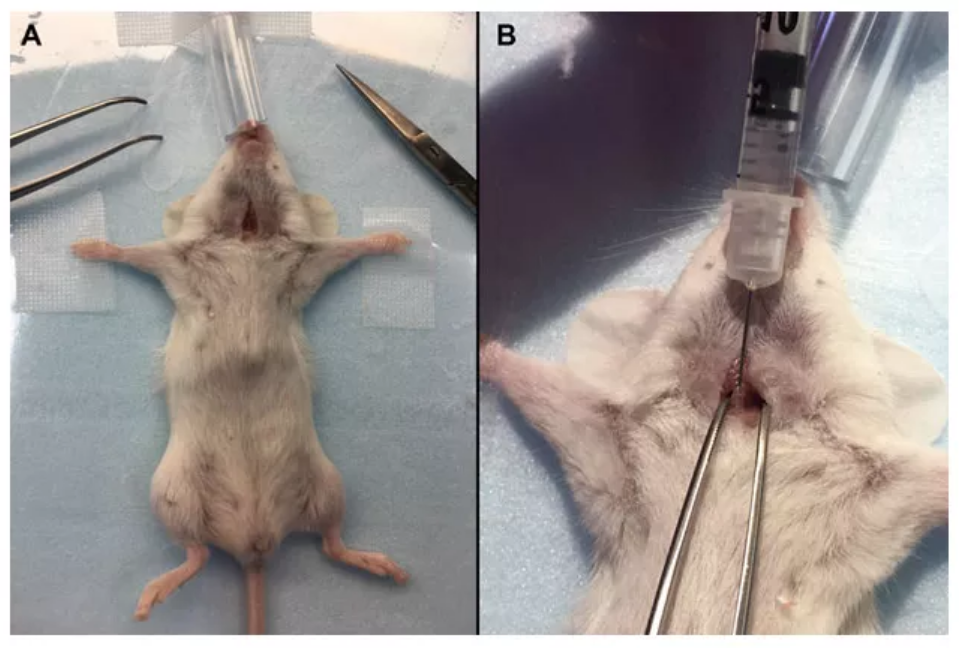
『病毒包裝-AAV感染肺部』- 氣管內(nèi)注射
與鼻內(nèi)滴注相比,氣管內(nèi)注射能夠提高AAV進入肺部的效率����;與口腔氣管插管法相比,設(shè)備更簡單��,操作更容易�����。然而���,氣管內(nèi)注射具有極高的外科手術(shù)風(fēng)險�����,包括出血����、切口開裂���、感染以及較長的恢復(fù)期等。不僅如此�,由于小鼠氣管窄小,很容易出現(xiàn)操作失誤,將AAV注射到氣管周圍組織或食管中去����。
操作步驟:
(1)腹腔注射氯胺酮和甲苯噻嗪將小鼠麻醉;
(2)將小鼠以背臥姿勢固定在嚙齒動物工作臺上��,并將其前爪伸直固定��;
(3)剃除頸部部分區(qū)域的鼠毛����,并用碘伏做消毒處理;
(4)用手術(shù)剪刀在頸部做一個5~7mm的小切口���;
(5)手握鑷子固定住小鼠氣管�����,另一只手握住注射器�,使注射器針頭斜面朝上����,與氣管成45°。
注意:一旦針頭插入���,輕輕地將針頭向外移動����,遠離小鼠身體,確定針頭是否正確地插入氣管����。
(6)將40~80μL 的AAV緩慢注入氣管,等待5s后慢慢取出針管�;
(7)縫合傷口,將小鼠放回籠中恢復(fù)���,直到完全清醒�����。
『病毒包裝-AAV感染腎臟』- 經(jīng)輸尿管腎盂逆行注射
經(jīng)輸尿管腎盂逆行注射后���,基因表達分布在腎臟管道系統(tǒng),可以克服腎小球屏障限制��,但注射較難�,技術(shù)挑戰(zhàn)性較大�,可根據(jù)具體實驗?zāi)康暮蛯嶋H情況選擇合適的注射方式���。下面來分享一下經(jīng)輸尿管腎盂逆行注射的操作手法:
經(jīng)輸尿管腎盂逆行注射的操作方式:
① 對C57BL/6 小鼠(4-6 周齡,15-20g)進行麻醉手術(shù)����,并使小鼠呈仰臥姿勢于操作臺上;
② 在小鼠左腹部做一個切口并輕輕剖開�,找到輸尿管遠端和腎動脈并用顯微止血夾夾住�;
③ 用 30G注射針刺破輸尿管,將注射針貼合于管壁并固定到位����,使用 6-0縫線縫合以防液體泄漏;
④ 將尿液輕輕吸出����,將注射器替換為另一個含有約 50ul液體(含有 5*10E10個病毒顆粒基因組拷貝數(shù)或PBS)的注射器��,并緩慢地將液體逆行注入輸尿管����;
⑤ 將注射針撤出,并在注射部位的近端放置一個顯微止血夾以防液體泄漏����;
⑥ 5min后�����,移去輸尿管遠端����、近端及腎動脈上的顯微止血夾��,用6-0縫線將切口分兩層縫合����。
『病毒包裝-AAV感染腎臟』- 經(jīng)腎實質(zhì)腎盂注射
經(jīng)腎實質(zhì)腎盂注射后,基因表達分布在皮質(zhì)和髓質(zhì)的腎小管上皮細胞中�����,主要是集合管細胞�。此方法是一種新的注射方式,操作簡單�,基因表達穩(wěn)定。下面分享一下經(jīng)腎實質(zhì)腎盂注射的操作方式供參考:
經(jīng)腎實質(zhì)腎盂注射的操作方式:
① 對C57BL/6 小鼠(4-6 周齡�����,15-20g)進行麻醉手術(shù),并使小鼠呈仰臥姿勢于操作臺上��;
② 對小鼠左腹進行剃毛處理����,切開一個2cm的切口暴露左腎和輸尿管����,并將周圍器官和脂肪輕輕分開;
③ 用顯微止血夾夾住輸尿管上段以阻止病毒原液下流至膀胱���;
④ 用30G注射針刺入左腎中極的腎盂(注意注射針頭不應(yīng)刺穿腎盂)��,將50μL液體(含5*10E10個病毒顆?��;蚪M拷貝數(shù)或PBS)注入腎盂;
注:注射針刺入腎盂而不刺穿腎盂的關(guān)鍵在于注意比對穿刺針和小鼠腎臟��,并且在注射針上做好標(biāo)記����;
⑤ 5min后移去顯微止血夾,將切口分兩層縫合��。
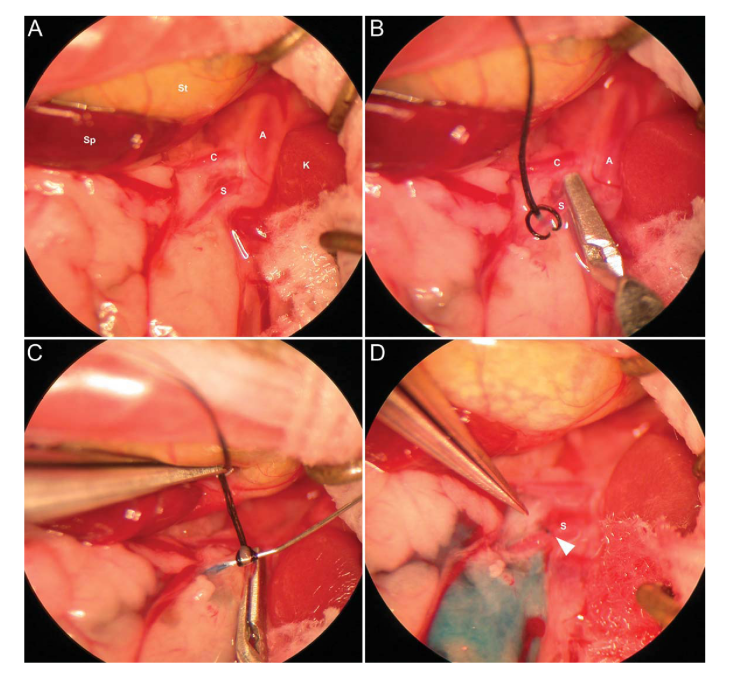
『病毒包裝-AAV感染腎臟』- 腎靜脈注射
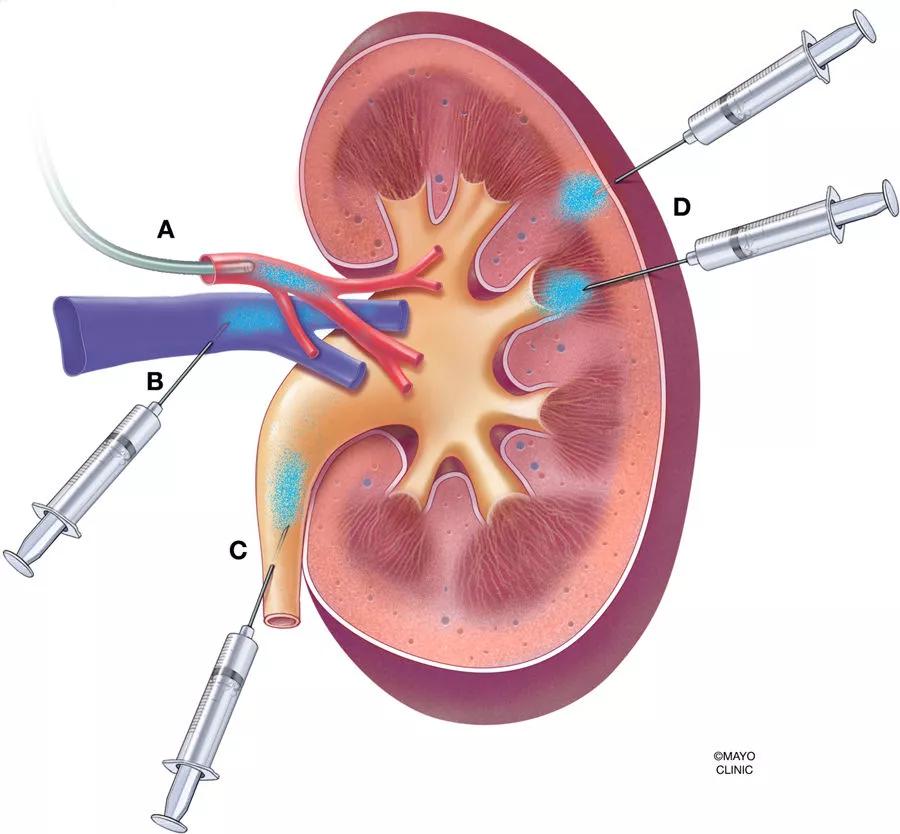
哺乳動物的腎臟具有嚴(yán)格的過濾功能,排斥大于50kDa的蛋白質(zhì)��,此外����,腎小球內(nèi)的足細胞形成直徑僅為10nm的狹縫橫膈膜,傳統(tǒng)的AAV載體全身給藥難以在腎臟達到足夠的表達水平��,即便是高劑量給藥也會導(dǎo)致AAV集中在肝臟等腎外器官中���。為了提高病毒載體對腎臟的轉(zhuǎn)導(dǎo)并降低病毒載體對腎外器官的轉(zhuǎn)導(dǎo)效率��,除了全身給藥方式外����,近年來����,科學(xué)家陸續(xù)開發(fā)了腎臟局部給藥途徑包括腎動脈注射、腎靜脈注射����、經(jīng)腎實質(zhì)注射、經(jīng)輸尿管逆行給藥和經(jīng)腎實質(zhì)腎盂注射等(圖1)。
圖3. 腎臟AAV給藥方式
(A) 腎動脈灌注�,通過導(dǎo)管或注射器;(B)腎靜脈逆行灌注�����;(C)逆行輸尿管灌注�����;(D)經(jīng)腎囊壁直接向腎實質(zhì)注射���。
(Rubin, J.D. and M.A. Barry. Mol Diagn Ther, 2020.)
腎靜脈注射的操作方式:
攜帶目的基因的病毒載體通過腎靜脈注射后,基因可在皮質(zhì)和髓質(zhì)中表達��,主要在腎小球和近端小管中表達���,但難以突破腎小球屏障�����,效率較低�。下面就來分享一下腎靜脈注射的操作方式:
① 對C57BL/6 小鼠(4-6 周齡��,15-20g)進行麻醉手術(shù),并使小鼠呈仰臥姿勢于操作臺上����;
② 給小鼠左腹剃毛,在小鼠左腹部做一個切口�����,暴露左腎及腎蒂����,并將腎靜脈從腎蒂中游離;
③ 用顯微止血夾夾住腎靜脈遠端以阻止病毒原液流出腎臟�����;
④ 用30G注射針刺入左腎靜脈近端����,將50μl液體(含有 5*10E10個病毒顆粒基因組拷貝數(shù)或 PBS)注入腎靜脈���;
⑤ 5min后�,拔出注射針�����,移去顯微止血夾并壓迫止血片刻,將切口分兩層縫合��。
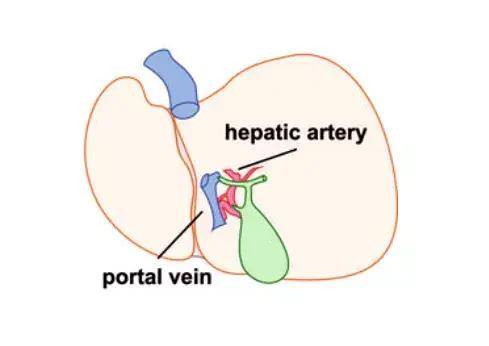
『病毒包裝-AAV感染肝臟』- 肝門靜脈注射
AAV在肝臟中的注射方式分為直接傳送和外周傳送兩種(下表所示)�,直接傳送靶向性高但侵入性強且對實驗技能要求高,外周傳送操作簡單但靶向性稍差����,操作者可根據(jù)實驗?zāi)康倪x擇合適的注射方式。
|
注射
方式
|
覆蓋
|
優(yōu)點
|
缺點
|
直接
傳送
|
肝葉注射�����、門靜脈注射���、脾包膜注射;肝動脈注射(大動物與人)����;
|
克服了轉(zhuǎn)導(dǎo)效率低的問題,靶向性高���,所需病毒量少���;
|
侵入性強���,風(fēng)險大,實驗操作技能要求高�;
|
外周
傳送
|
腹腔注射和靜脈注射(尾靜脈注射和眶后靜脈竇注射等);
|
操作簡單�����,無須手術(shù)或麻醉��;
|
靶向性較直接傳送稍差���,可能需要較多的注射體積�;
|
下面來介紹一下直接傳送方式中肝門靜脈注射的操作手法:
01
通過腹腔注射麻醉劑將成年小鼠麻醉��,對小鼠腹部局部區(qū)域做去毛及消毒處理��;
02
在距劍突軟骨下方2-3mm處��,做一個2-3cm的中線切口��。
03
暴露門靜脈�����,使用30G針頭在1min內(nèi)均勻緩慢注射0.2 ml病毒懸液。
注:門靜脈是一種相對較大的靜脈��,提起肝前葉一般即可看到門靜脈�����。在手術(shù)過程中��,用浸泡在生理鹽水中的無菌紗布覆蓋腸道�����,保持腸道濕潤�。
04
注射后保持針位約10-20秒��。取出針后����,做好防出血處理;
05
縫合腹部�,將小鼠放置于加熱燈下,直至恢復(fù)意識��。然后將其放回籠子單獨飼養(yǎng),直到傷口完全愈合���。
圖4. 小鼠肝臟門靜脈�、肝動脈示意圖
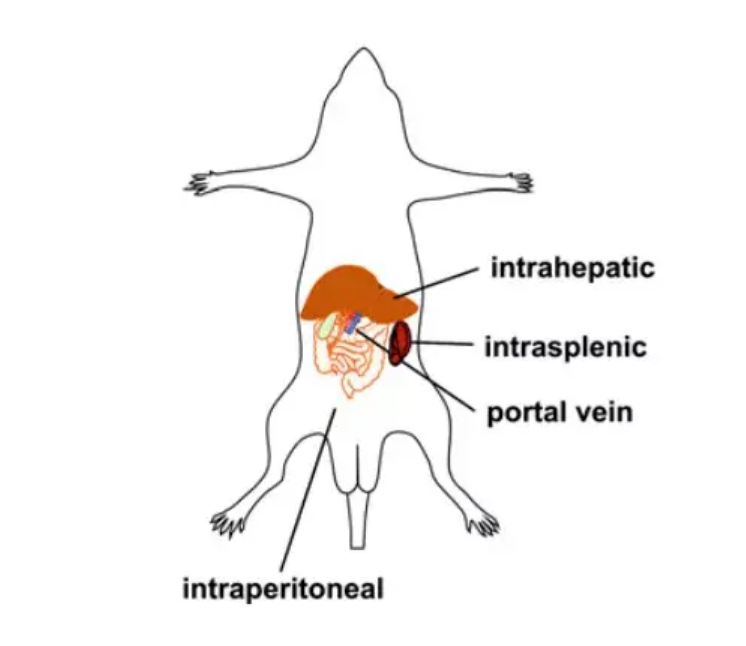
『病毒包裝-AAV感染肝臟』- 肝內(nèi)注射
肝內(nèi)注射可以克服轉(zhuǎn)導(dǎo)效率低的問題��,靶向性高��,所需病毒量少�����;缺點則是侵入性強�����,風(fēng)險大�,實驗操作技能要求高,研究者可根據(jù)實驗?zāi)康倪x擇合適的操作方式�����。下圖為小鼠肝臟AAV給藥途徑示意圖:
圖5. 小鼠仰臥位圖��,顯示非手術(shù)腹膜內(nèi)和手術(shù)肝內(nèi)�、脾內(nèi)和門靜脈輸送路徑
(Palaschak, B., R.W. Herzog and D.M. Markusic, Methods Mol Biol, 2019.)
操作手法:
01 通過腹腔注射麻醉劑將成年小鼠麻醉��,對小鼠腹部局部區(qū)域做去毛及消毒處理�����;
02 在距劍突軟骨下方2-3mm�,做一個2-3cm的中線切口�,以露出肝臟。
03 用固定在結(jié)核菌素注射器上的30G針頭將病毒懸液緩慢注入肝實質(zhì)中���。
注:在注射過程中通過手術(shù)立體鏡監(jiān)測注射部位��,確保無出血或外滲��。如果出現(xiàn)上述任何一種情況���,需取出針頭,輕輕按壓止血��,然后選擇一個新的部位進行注射��。
04 取出針���,用無菌紗布輕輕按壓止血�。
05 再選擇其他部位進行注射����。
06 縫合腹部,將小鼠放置于加熱燈下�����,直至恢復(fù)意識����。然后將其放回籠子單獨飼養(yǎng),直到傷口完全愈合���。
注:一只成年小鼠一次可選擇4 ~ 5個不同的注射位點(40 ~ 50μl/site)���,總劑量可達200μl。
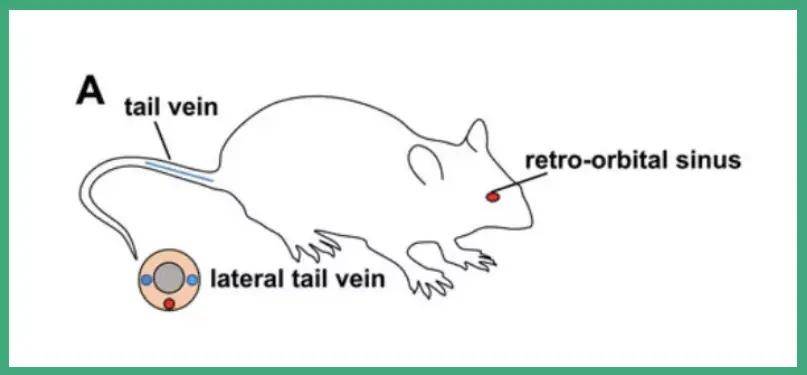
『病毒包裝-AAV感染肝臟』- 靜脈注射
肝臟對全身應(yīng)用AAV有較高的親和性����,使用外周傳遞方式如靜脈注射,配合AAV8等肝臟嗜性較強的血清型以及TBG等肝臟特異性啟動子也可以較好的將目的基因遞送到肝臟進行表達���,操作方式簡單且對動物侵入性傷害較小���。
圖6. (A)小鼠側(cè)視圖��,顯示側(cè)尾靜脈或眶靜脈竇注射路線
(Palaschak, B.,R.W. Herzog and D.M. Markusic, Methods Mol Biol, 2019.)
今天介紹一下尾靜脈注射和新生小鼠靜脈注射的操作手法:
1. 尾靜脈注射
將小鼠放在標(biāo)準(zhǔn)限制器中���,使注射器能夠完全接觸到整個尾巴長度。
將一根30G的針頭固定在1cc結(jié)核菌素注射器上��,盡可能遠的插入尾部側(cè)面靜脈���。選擇一個遠端部位�,如果第一次注射失敗�,可以選擇另一個更近端的注射部位。
注:a:小鼠尾巴上較容易接觸到的靜脈位于尾巴的側(cè)面�����,且側(cè)靜脈非常淺����,無需進針很深;小鼠尾部背面的靜脈很難常規(guī)注射�����;尾部腹面的血管是動脈���,不可注射����。b:注射前用溫水輕輕地加熱尾巴�,可以使血管得到一定程度的舒張,便于注射���。
注射完成后取下針頭�,輕輕按壓止血�,然后立即將小鼠放回籠中。
注:使用此方法注射成年小鼠�,病毒用量控制在300 -400μl較佳。
2. 新生小鼠靜脈注射
需兩個人配合完成��,一人固定����,一人注射;
注射前將小鼠置于干毛巾上���,減少活動及損傷���;
一人輕輕固定小鼠����,使側(cè)面朝上����,暴露眼睛至頸部的顳淺靜脈,置于放大鏡下����;
另一人沿著自頭至頸的方向?qū)?0G的注射針頭插入靜脈旁的皮下,慢慢推進靜脈(新生鼠皮膚呈現(xiàn)半透明��,較易觀察)���;
慢慢注射病毒懸液����;(如果注射成功�����,注射部位遠端靜脈會呈白色,如果未成功��,皮下注射10μl即可看到明顯的隆起)
注射完成后�����,取下針頭�,輕輕按壓靜脈�,通常2-3分鐘會停止出血;
將新生鼠在加熱燈下照射后����,放回母鼠身邊;
如果注射不成功�,讓小鼠恢復(fù)5-10分鐘,然后在另一側(cè)嘗試第二次注射�����;
注:使用此方法注射新生小鼠��,病毒用量控制在100μl以內(nèi)較佳���。
『病毒包裝-AAV感染眼睛』- 視網(wǎng)膜下注射
視網(wǎng)膜下注射(SR)是將藥物注入光感受器細胞和RPE之間的視網(wǎng)膜下腔���,這需要使視網(wǎng)膜的神經(jīng)上皮層與色素上皮層分離���,形成視網(wǎng)膜下腔。SR是將基因直接遞送至RPE細胞或光感受器細胞的有效方法�����,但此方法侵入性較大���,容易使視網(wǎng)膜脫離��,可能會引起膠質(zhì)細胞增生����、光感受器退化及視力功能損傷等��,并且藥物擴散有限只能實現(xiàn)局部轉(zhuǎn)導(dǎo)��。
視網(wǎng)膜下腔注射����,主要轉(zhuǎn)染視網(wǎng)膜色素上皮細胞和光感受器細胞,不會觸發(fā)體液免疫反應(yīng)���,對另一只眼再次視網(wǎng)膜下注射也無影響��。
圖7. 視網(wǎng)膜下注射方式
(https://www.pharmacology.cup.uni-muenchen.de/research/retinal_gene_therapy/index.html)
小鼠視網(wǎng)膜下腔注射步驟:
1����、麻醉:對于成年小鼠,異氟醚吸入麻醉或聯(lián)合使用氯胺酮(100mg/ml)和賽拉嗪(20mg/ml)按照0.1ml/10g腹腔注射; 對于圍產(chǎn)期小鼠���,異氟烷吸入麻醉或低溫麻醉;
2�����、使用Vannas直剪沿著閉合的眼瞼裂開大約1.5 mm的切口��;注意切口不要太大��;
3�、用彎曲的敷料鉗將眼皮分開,以支撐眼睛��,并在眼睛下方稍微捏緊眼皮��,將其拿起以供注射��;
4、在眼球中緯線或中緯線后方做一個小的鞏膜切口�,切口夠注射針尖端通過即可;
5����、小心地將注射針插入切口部位,并平行于眼外壁進入視網(wǎng)膜下腔���;
6����、開始注射����,如果正確注射至視網(wǎng)膜下腔,能感受到適度的阻力�����;緩慢出針���,可將針頭固定15s����,避免注射病毒回流到切口位置;
7�����、使用彎曲的敷料鉗輕輕地將眼睛推回眼眶���;將適量0.25%布比卡因���,滴在注射部位;
8����、小鼠蘇醒后置于加熱墊上�,整個注射過程控制在5min內(nèi)完成;
9����、小鼠恢復(fù)活動能力后放回鼠籠。
『病毒包裝-AAV感染眼睛』- 玻璃體腔注射
玻璃體腔注射(IVT)是將藥物直接注入眼球玻璃體腔內(nèi)�,侵襲性較小、術(shù)后并發(fā)癥較少���,但由于內(nèi)界膜ILM的存在��,大多數(shù)AAV血清型無法傳遞至RGCs之外的細胞內(nèi)�。
玻璃體腔注射較適用于視網(wǎng)膜神經(jīng)節(jié)或Müller神經(jīng)膠質(zhì)細胞的靶向。此種注射方法會產(chǎn)生針對AAV衣殼蛋白的體液免疫反應(yīng)�,這種反應(yīng)可阻礙再次注射時AAV的表達,如果兩只眼都需要連續(xù)治療的話����,需要避免使用這種注射方式。
小鼠玻璃體腔注射步驟:
1�����、麻醉:4.3%水合氯醛 0.01ml/g �����;
2�、散瞳:建議雙眼散瞳,以防一眼出現(xiàn)意外時可以迅速換眼����;
3、甲基纖維素保持眼表濕潤�;
4、抗生素眼藥水���、表麻藥術(shù)前滴眼��;
5�、調(diào)整小鼠頭位,讓小鼠眼球保持角膜緣水平位����;
6、注射位置:理論上是角膜緣后1mm�����,也有選擇在顳側(cè)進行�����,注意避開血管��。白鼠還可以看見視網(wǎng)膜血管�,需避開�;
7、注射切口:推薦使用ALCON的10-0針做切口��,非常整齊����,33G的針進去水密非常好��。也可以用破囊針�。切口越整齊�,跟針越匹配,越不易滲漏���;
8�、注射進針:針尖垂直進入����,隨后傾斜。這一步非常關(guān)鍵�����,小鼠眼球小���,晶體球形�����,傾斜角度小了會損傷晶體���,大了會扎上視網(wǎng)膜��,出血��;
9����、注射:緩慢推注��,無阻力����。迅速推注的話取材時會發(fā)現(xiàn)視網(wǎng)膜散在出血點,可能干擾試驗結(jié)果�����。推針以后留針0.5-1min�,迅速出針��。
『病毒包裝-AAV感染神經(jīng)系統(tǒng)』- 腦立體定位注射
腦定位注射�����,相比其他注射方式靶向性強,注射病毒體積小�,但是侵入性也強,且對操作者具有很高的要求����。在立體定位手術(shù)時,顱骨上常用的注射參照點是前囪����,也就是中矢狀冠狀縫的交叉點。具體的注射部位����,可依據(jù)研究的需要而確定。
注射步驟:
1��、安裝定位儀:在生物安全柜中安裝立體定位框架和工具���。
2�����、準(zhǔn)備并吸取病毒懸液:在噴嘴出安裝超微量注射器�,把針尖浸在準(zhǔn)備好的AAV病毒懸液中,并使用“快速反向”功能吸取��。
3�����、排除空氣:使用“快速正向”功能檢查泡沫�����,直到在針頭處出現(xiàn)一滴液體�����。用浸泡在0.1M NaOH溶液中的棉花輕輕拭去針尖的液滴��。
4����、麻醉大鼠:選取250g左右的大鼠,通過25G 1毫升注射器注射甲苯噻嗪(10mg/kg)和氯胺酮(100mg/kg)���。
5����、固定大鼠:首先將大鼠的下切牙固定在齒棒上����,然后用耳棒通過大鼠的外耳道進行固定,并固定頭部�。檢查顱骨是否是水平的,并確保兩個眼睛在同一水平線上��。在每只眼睛中滴入一滴聚丙烯酸����,以防麻醉造成眼睛干燥。調(diào)整光源對準(zhǔn)大鼠的頭部����,剃去頭部的毛并用酒精消毒清潔。
6���、切口并暴露前囪點:用刀片在頭皮上前后軸切口��,并用鉗子保持刀口開放狀態(tài)�����,用棉球吸去血���。去除骨膜以便看到前囪�����。
7��、暴露λ點:調(diào)整齒夾的垂直位置��,使得前囪點和λ點的高度一致����,如果λ點的位置難以看到����,讓切口處干燥5-10min后再尋找。
8�、確定前囪點的AP和ML坐標(biāo)和目標(biāo)注射點的距離:將針垂直于前囪點,并記錄AP和ML坐標(biāo)的數(shù)值�。參考大鼠腦圖譜的標(biāo)記的目標(biāo)注射部位的AP和ML值,計算前囪點與目標(biāo)注射部位的AP和ML坐標(biāo)���,并做標(biāo)記���。
9����、確定前囪點的DV坐標(biāo)和目標(biāo)注射點的距離:用鉆頭在顱骨上打洞����,注意不要損傷硬腦膜��。把針尖置于硬腦膜的表面并測量出前囪點DV的坐標(biāo)���。計算目標(biāo)注射部位的DV坐標(biāo)�。
10����、注射AAV:緩慢垂直移動注射器針尖到達目標(biāo)注射部位,慢慢地將針插入并靜置5min���。然后��,以0.2 μl/min的速度�����,將2μL的病毒懸液注射入腦�。結(jié)束后,需要靜置5min再將注射器緩慢移出��。
11���、縫合并做標(biāo)記:縫合頭皮�,并做耳標(biāo)�。
12、大鼠術(shù)后的護理:將大鼠單獨放在一個干凈的籠子里�����,直到醒來����。第一天需要讓大鼠在獨立的通風(fēng)籠中度過。
13�、處理針頭和手術(shù)材料:先用0.1 M NaOH 或10%氯漂白劑清洗手術(shù)工具,并用蒸餾水沖洗�����,最后用酒精沖洗�。
圖1. 小鼠頭部被安裝在立體定位儀上
(ZMD et al. Springer New York, 2014)
『病毒包裝-AAV感染神經(jīng)系統(tǒng)』- 鞘內(nèi)注射
與系統(tǒng)注射和實質(zhì)內(nèi)注射相比,鞘內(nèi)給藥是一種具有較低劑量要求的微創(chuàng)替代方法。
注射步驟:
1��、使用毛巾覆蓋在小鼠頭部和背部�����,露出髂嵴以下的腰部區(qū)域���;用非慣用手的拇指和食指抓住鼠的髂骨(髖骨)�����,手的頂部輕輕放在小鼠身體和頭部上,使其保持平靜���。
注:在髂骨上的握力應(yīng)該足夠強�����,以固定小鼠的腿部活動�����,并使腿部向外和向下伸展�����。
2�、使用慣用手食指從腰椎到骶部沿脊柱輕輕按壓,同時使用非慣用手輕輕上拉小鼠���,以打開椎節(jié)之間的空間����,方便進針��。
3�、將1 ?”號針的斜面指向小鼠頭部,然后將針以70°角插入脊柱中線的腰椎處�,當(dāng)感覺針碰到骨頭時,將針的角度調(diào)整到30°夾角���,并將針插入椎節(jié)之間��。
注:需多次嘗試找到合適的進入點�����,針頭進入脊柱后推針沒有阻力���,尾巴或后腿的反射性彈跳出現(xiàn)時�,說明已正確入針���。
4��、輕輕壓下注射器的活塞���,將5-10μL的AAV病毒懸液注射至蛛網(wǎng)膜下腔。
注:注射時間控制在10-30s較好��,速度太快會導(dǎo)致小鼠后腿抽筋����,該現(xiàn)象會在60s內(nèi)消失���。
5��、注射后���,將針180°旋轉(zhuǎn)1-2次,然后將針從脊柱中取出�����。
6、小鼠放回籠子觀察�,確認(rèn)恢復(fù)正常運動功能。
注:此法適用于成年小鼠或大鼠�����。
『AAV注射專題』之腸道-灌腸
腸組織常見的注射方式有尾靜脈注射�����、腹腔注射��、口服��、灌腸和腸系膜上動脈(SMA)注射等�。其中尾靜脈注射和腹腔注射作為系統(tǒng)性給藥方式,雖然操作簡單���,損傷性小����,但是注射量較大��,特異性不強?��?诜凸嗄c���,都屬于腔內(nèi)給藥,主要是黏膜的轉(zhuǎn)導(dǎo)����,由于胃酸及腸蛋白水解酶等的中和作用,其轉(zhuǎn)導(dǎo)效率并不高���,但操作簡單���。
灌腸的操作步驟:
(1)小鼠禁食過夜,并預(yù)先用NAC和毛果蕓香堿處理以促進腸道隱窩黏液排出����。
(2)使用異氟醚將小鼠麻醉����。
(3)在不使用鎮(zhèn)靜劑的狀態(tài)下,用1英寸不銹鋼的直圓針頭直腸注射300ul 20mM的NAC清洗結(jié)腸30min���。
(4)再次麻醉小鼠��,通過灌腸給予小鼠5*10E10vg���,600uL體積量的AAV��。
注:可通過直腸注射亞甲基藍觀察液體到達盲腸的預(yù)實驗����,確定合適的灌腸液體積�。
『AAV注射專題』之腸道-腸系膜動脈注射
腸系膜動脈(SMA)注射效果較好,但對實驗條件和操作手法要求較高���,對小鼠傷害性也較大��。
腸系膜動脈(SMA)注射操作步驟:
(1)將小鼠以右側(cè)臥位固定在手術(shù)板上��,保持四肢松弛����,放入含2-4.5% O2的異氟醚誘導(dǎo)室進行麻醉��。小鼠深度麻醉后��,將其放在手術(shù)臺上,對小鼠手術(shù)區(qū)域做去毛及消毒處理�。
注:為保持小鼠體溫,可在手術(shù)板下放置加熱墊�����。整個手術(shù)過程在手術(shù)顯微鏡下放大5-40倍進行操作���。
(2)手術(shù)開始前�����,皮下注射丁丙諾啡進行手術(shù)鎮(zhèn)痛����;沿左腋線最后一個肋間隙和肋下區(qū)域注射布比卡因進行局部鎮(zhèn)痛����。
(3)沿著腋線和側(cè)腹,在脾臟區(qū)域的左側(cè)皮膚上開一個1-2 cm的切口���,切開腹外斜肌,使用微型牽引器將皮膚和腹壁固定����,并用溫鹽水紗布覆蓋小腸防止縮回���,暴露SMA。
(4)在放大20倍的情況下���,將SMA輕輕地從腹膜后剝離����,在SMA的近端接頭周圍放置一個小的穩(wěn)定接頭連接注射針����,使用微血管夾暫時切斷腹主動脈的血液供應(yīng)。
(5)將定制33號1/2”針頭連接到250μl漢密爾頓TLL氣密性進樣針注射器上�����,輕輕插入SMA進行病毒注射(1*10E11vg, 200μL體積的AAV8)�����。將固定帶輕扎血管���,防止注射部位泄漏��。
注:注射過程中使用顯微鏡觀察以確保注射可視準(zhǔn)確��。
(6)注射后立即取下針頭����,縫合注射部位。取下固定帶和微血管夾����,使血液回流至小腸。使用無菌棉簽輕輕按壓注射部位進行止血�。
(7)在腹腔內(nèi)注射1ml無菌溫鹽水后,對小鼠進行縫合�。
(8)術(shù)后每15min對小鼠進行一次監(jiān)測,直到小鼠能夠腹臥�����。每2小時對動物進行一次監(jiān)測���,直至放回籠中�。
圖1 小鼠SMA注射過程中顯微手術(shù)步驟的代表性照片
(Porvasnik S L , Mah C , Polyak S . Microsurgery, 2010.)