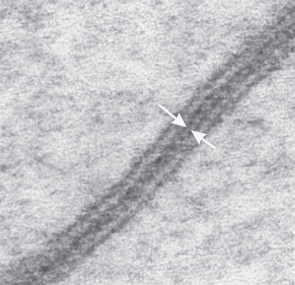
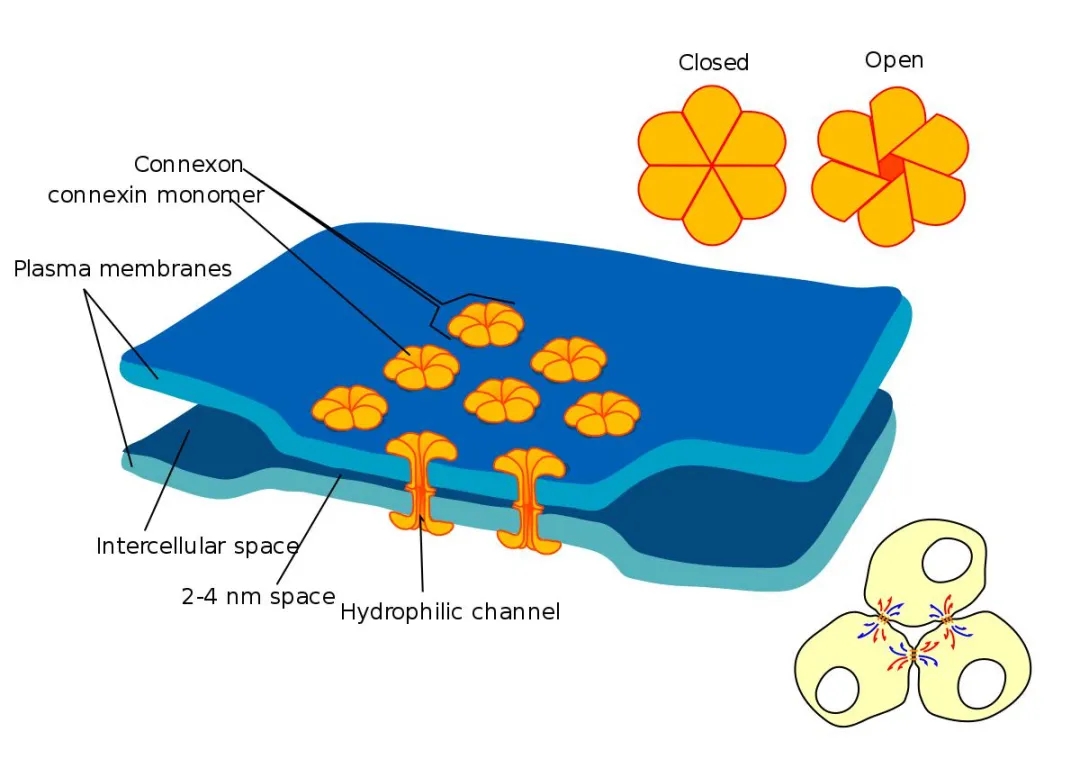
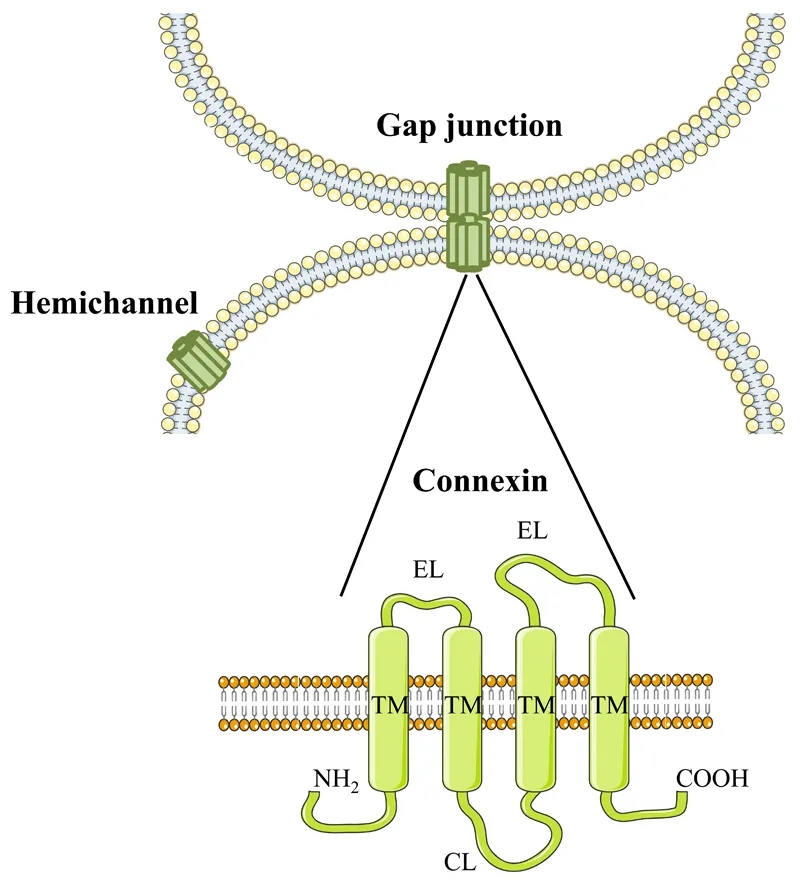
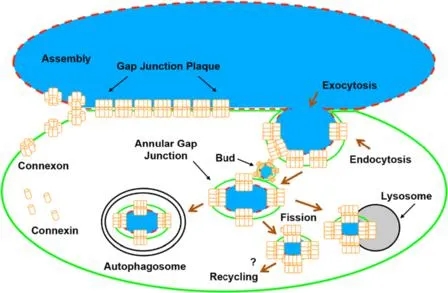
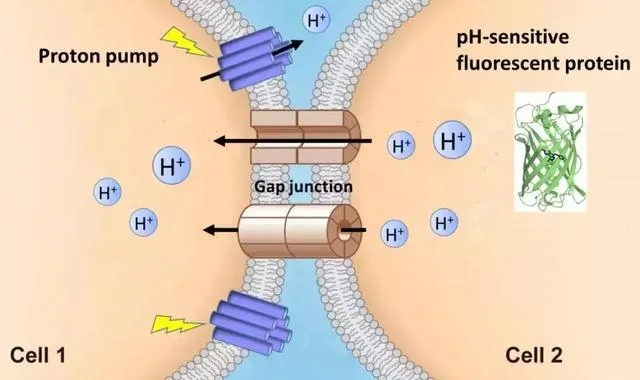
1����、PARIS與FRAP(熒光漂白恢復(fù)技術(shù))在HEK293T細(xì)胞中的功能比較
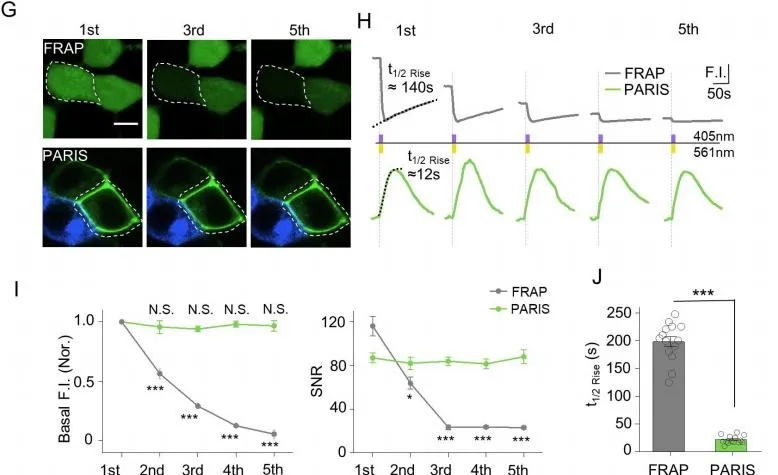
通過(guò)對(duì)PARIS與FRAP(基于染料擴(kuò)散的方法檢測(cè)縫隙連接介導(dǎo)的光漂白后的熒光恢復(fù))的比較發(fā)現(xiàn)��,相同時(shí)間內(nèi)PARIS信號(hào)比FRAP信號(hào)更加穩(wěn)定���,未曾出現(xiàn)衰減���,而且PARIS信號(hào)的動(dòng)力學(xué)比FRAP快速,對(duì)應(yīng)的t1/2分別約為~21s和~197s(圖6)���。
圖6. PARIS與FRAP在HEK293T細(xì)胞中的比較
2����、PARIS可檢測(cè)縫隙連接和由連接蛋白編碼基因突變引起的疾病
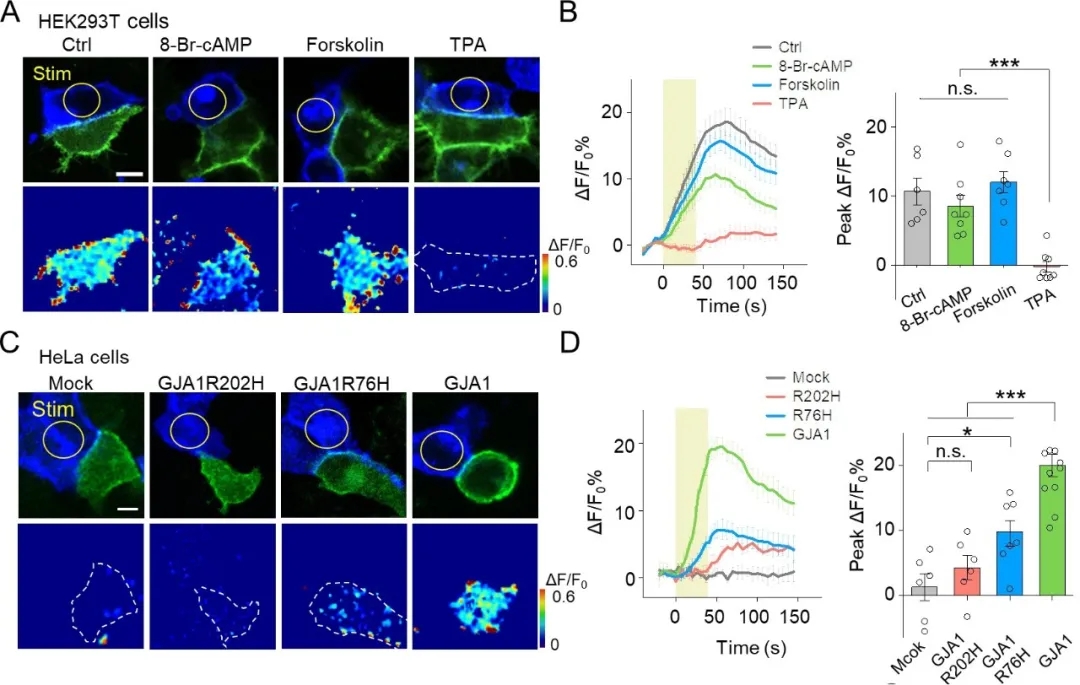
研究表明���,磷酸化通過(guò)影響縫隙連接的組裝、降解和門控等途徑參與其調(diào)節(jié)�����。接下來(lái),作者探討了PARIS是否可以在蛋白磷酸化等調(diào)節(jié)條件下檢測(cè)縫隙連接:用cAMP類似物8-Br-cAMP����、腺苷酸環(huán)化酶激動(dòng)劑Forskolin及蛋白激酶C(PKC)激動(dòng)劑TPA處理表達(dá)PARIS的HEK293T細(xì)胞。與對(duì)照組相比��,經(jīng)TPA處理細(xì)胞后���,PARIS信號(hào)受到顯著抑制����,而8-Br-cAMP和Forskolin的處理對(duì)其未造成明顯影響,表明PKC的激活會(huì)抑制縫隙連接���。
已知連接蛋白Cx43編碼基因GJA1的突變與許多疾病有關(guān),那么PARIS是否可以用來(lái)檢測(cè)連接蛋白編碼基因突變引發(fā)的疾病呢?作者在不表達(dá)內(nèi)源性連接蛋白的HeLa細(xì)胞中表達(dá)了PARIS��,光激活“質(zhì)子泵”細(xì)胞時(shí),接收器細(xì)胞中未產(chǎn)生PARIS信號(hào)�;而在表達(dá)GJA1的HeLa細(xì)胞中��,光激活“質(zhì)子泵”細(xì)胞時(shí)�����,相鄰接收器細(xì)胞中產(chǎn)生了強(qiáng)烈的熒光��。由于Cx43編碼基因GJA1的突變影響了縫隙連接的形成���,從而使PARIS信號(hào)顯著降低。上述結(jié)果表明,PARIS可用于檢測(cè)縫隙連接蛋白編碼基因突變?cè)斐傻募膊��。▓D7)�����。
圖7. PARIS可檢測(cè)縫隙連接和由連接蛋白基因突變引起的疾病
3、PARIS可用于報(bào)告測(cè)心肌細(xì)胞間的縫隙連接
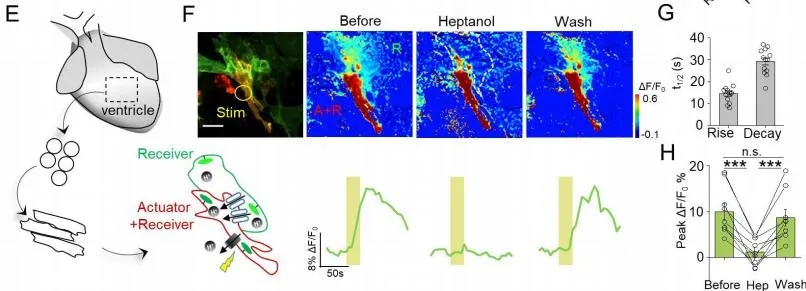
由連接蛋白Cx40����、Cx43和Cx45形成的縫隙連接在心肌細(xì)胞中起著重要作用���,它們的的缺陷與心血管疾病有關(guān)。作者用培養(yǎng)的新生大鼠心肌細(xì)胞,光刺激“質(zhì)子泵”心肌細(xì)胞��,在相鄰接收器心肌細(xì)胞中產(chǎn)生了強(qiáng)烈的熒光,并且這種熒光響應(yīng)可以被縫隙連接阻滯劑Heptanol可逆阻斷。此外��,光刺激“質(zhì)子泵”心肌細(xì)胞不影響細(xì)胞中自發(fā)的鈣離子瞬變速率以及細(xì)胞搏動(dòng)的速率,說(shuō)明PARIS的表達(dá)和激活不影響細(xì)胞的功能(圖8)����。
圖8. PARIS可監(jiān)測(cè)心肌細(xì)胞間的縫隙連接
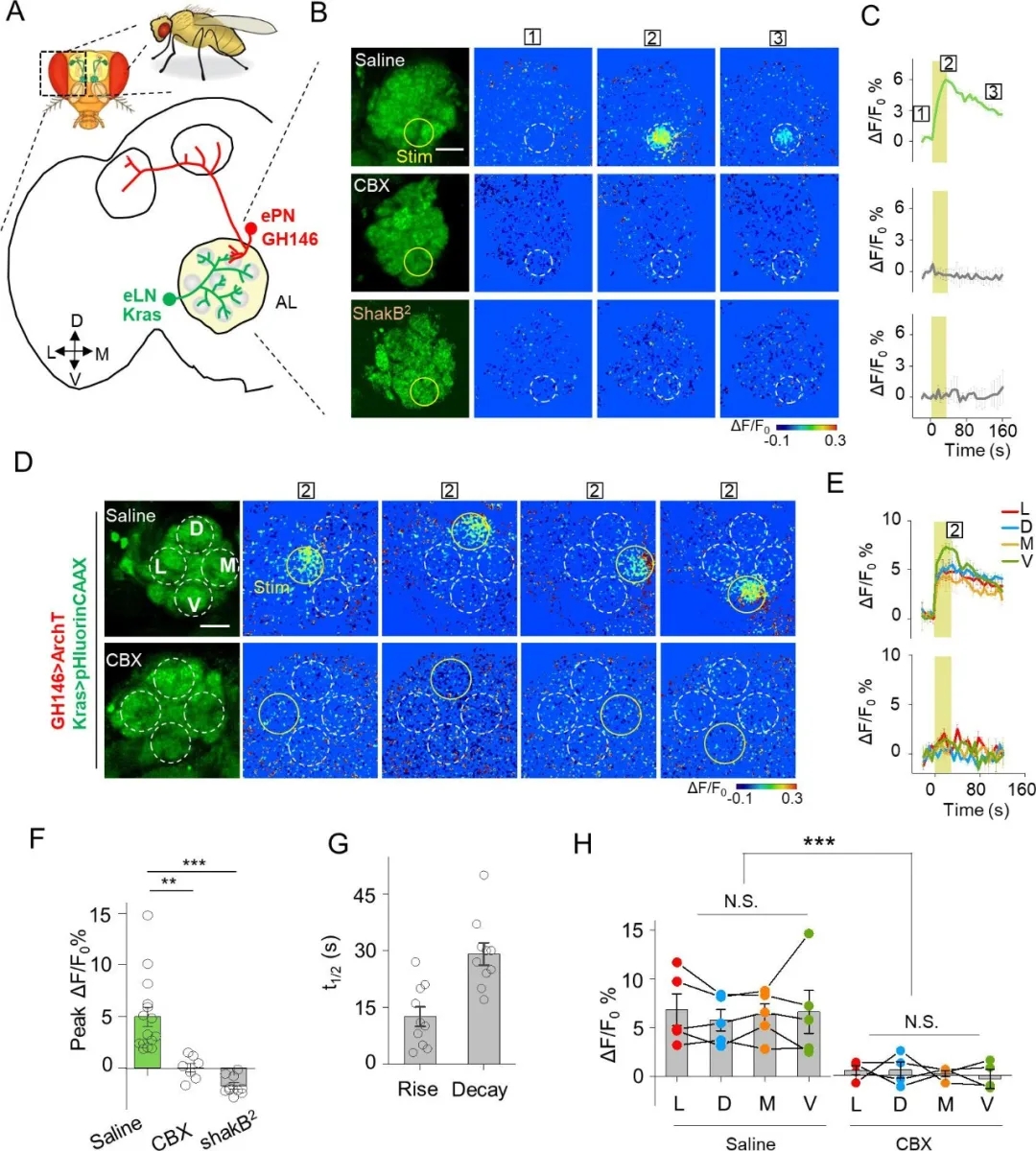
4、PARIS可監(jiān)測(cè)轉(zhuǎn)基因果蠅特定神經(jīng)元間的縫隙連接
接著�,作者檢測(cè)了PARIS是否可以用來(lái)測(cè)量腦細(xì)胞間的縫隙連接活動(dòng)(電突觸)�。首先����,作者在果蠅嗅覺通路的興奮性投射神經(jīng)元(ePNs)中表達(dá)了PARIS系統(tǒng)��,并測(cè)量了PARIS信號(hào),結(jié)果顯示ePNs中的自主PARIS信號(hào)可被重復(fù)誘導(dǎo)長(zhǎng)達(dá)2小時(shí)�����,并且信號(hào)強(qiáng)度無(wú)明顯減弱,表明PARIS在完整的活體組織中是穩(wěn)定的����。
隨后,作者利用PARIS測(cè)量了轉(zhuǎn)基因果蠅興奮性投射神經(jīng)元(ePNs)和興奮性局部神經(jīng)元(eLNs)間的電突觸——兩者在觸角葉(AL)中都有樹突狀分支:在ePNs中選擇性地表達(dá)光控質(zhì)子“泵”(GH146-QF > QUAS ArchT),在eLNs中選擇性地表達(dá)熒光傳感器(Kras-Gal4 >UAS pHluorinCAAX)��。在AL中直徑為20 um的區(qū)域施加光刺激,引起了pHluorinCAAX熒光的快速增加����,半上升和半衰減時(shí)間分別約為12 s和29 s,這與先前報(bào)道的電生理數(shù)據(jù)一致�,表明ePNS和eLNS是電耦合的����。用CBX處理轉(zhuǎn)基因蒼蠅或在突變體ShakB2果蠅大腦中(縫隙連接蛋白發(fā)生突變)并未出現(xiàn)類似熒光響應(yīng)�,證實(shí)了PARIS可用來(lái)測(cè)量轉(zhuǎn)基因果蠅特定神經(jīng)元間的縫隙連接�。
作者又將AL劃分為四個(gè)區(qū)域,光刺激可以誘導(dǎo)每個(gè)區(qū)域的熒光增加�����,表明電耦合在AL中EPNS和ELNS之間是普遍存在的(圖9)。
圖9. PARIS檢測(cè)轉(zhuǎn)基因果蠅特定神經(jīng)元間的縫隙連接
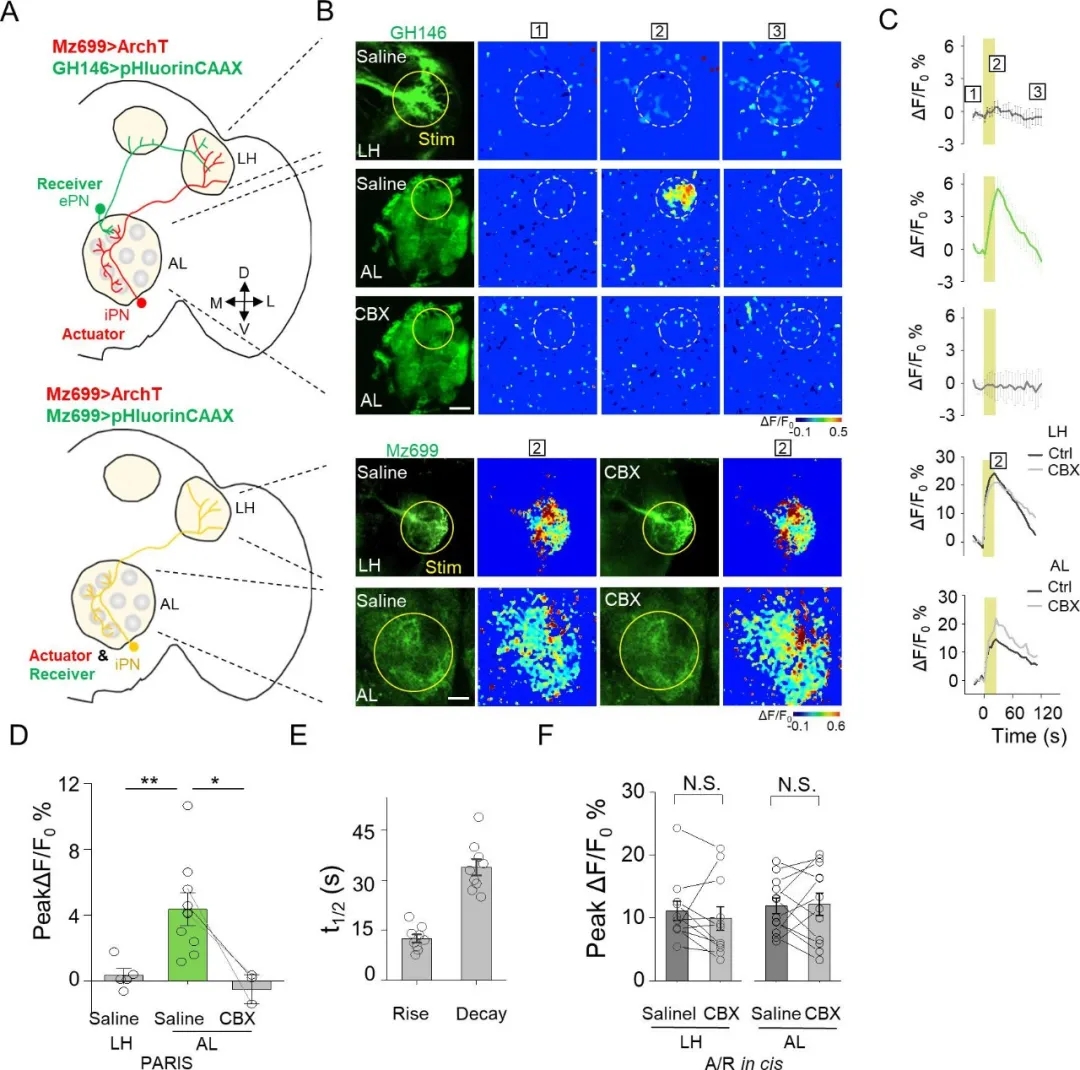
5�、PARIS可報(bào)告轉(zhuǎn)基因果蠅不同神經(jīng)元結(jié)構(gòu)中的功能性縫隙連接
在果蠅嗅覺系統(tǒng)中���,抑制投射神經(jīng)元(iPNs)和ePNs形成縫隙連接,參與對(duì)氣味信息的處理��;并且ePNS和iPNS都有投射到AL中的樹突以及投射到側(cè)角(LH)的軸突���。因此�����,目前尚不清楚在AL��、LH或兩者中的iPNS和ePNS之間是否形成縫隙連接�����。
作者在iPNS中表達(dá)了光控質(zhì)子“泵”(Mz699-Gal4 > UAS ArchT)����,在ePNS中表達(dá)了熒光傳感器(GH146-QF > QUAS pHluorinCAAX)����,然后光刺激AL或LH中ePNS-iPNS重疊的區(qū)域�����,檢測(cè)是否存在功能性縫隙連接�。結(jié)果顯示,光刺激AL���,而不是LH,引起了pHluorinCAAX熒光的顯著增加�����,并且用CBX處理后熒光響應(yīng)被消除���。上述結(jié)果表明iPNS和ePNS在AL處通過(guò)樹突-樹突接觸形成功能性縫隙連接��,而不是在LH中通過(guò)軸突-軸突接觸��。
圖10. PARIS監(jiān)測(cè)轉(zhuǎn)基因果蠅不同神經(jīng)元間的縫隙連接
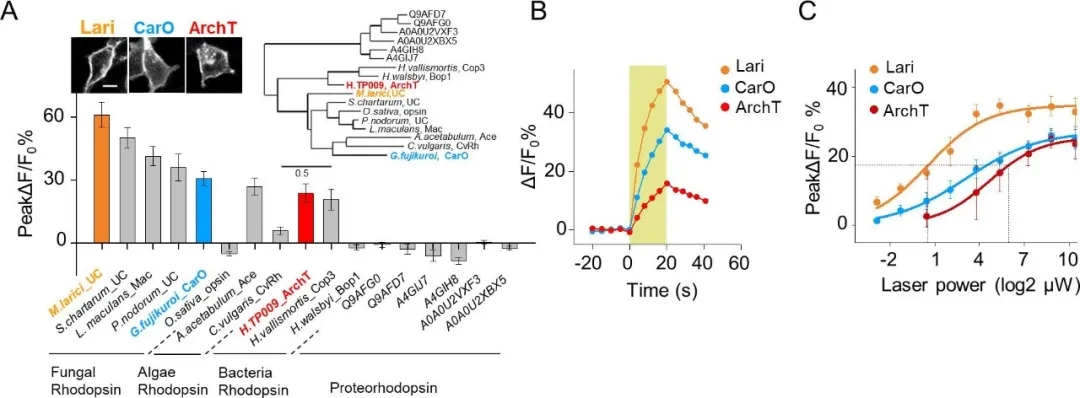
作者還進(jìn)一步優(yōu)化了PARIS系統(tǒng)��,通過(guò)生物信息學(xué)篩選出了比ArchT膜轉(zhuǎn)運(yùn)性能更優(yōu)異�����、光靈敏度更強(qiáng)(約25倍)的新質(zhì)子泵Lari,擴(kuò)展了PARIS系統(tǒng)在未來(lái)體內(nèi)應(yīng)用的前景(圖11)���。
圖11. 對(duì)PARIS系統(tǒng)的進(jìn)一步優(yōu)化