AAV在肝臟研究中的靶向策略【應(yīng)用篇】
無標(biāo)題文檔
肝臟作為較早被用于基因治療的器官,多年來研究熱度有增無減�,前期小V已經(jīng)與大家共同學(xué)習(xí)了在肝臟應(yīng)用中關(guān)于AAV的選擇策略,今天小V將分享幾個(gè)利用維真生物AAV進(jìn)行肝臟研究的文獻(xiàn)案例:
01
Tripartite motif 16 ameliorates nonalcoholic steatohepatitis by promoting the degradation of phospho-TAK1
非酒精性脂肪性肝炎(NASH)相關(guān)的肝細(xì)胞癌和肝病已成為發(fā)達(dá)國家需要肝移植的主要原因�����。脂質(zhì)過度積累導(dǎo)致的脂毒性能夠引起內(nèi)質(zhì)網(wǎng)應(yīng)激和破壞蛋白質(zhì)穩(wěn)態(tài)�,在NASH中發(fā)揮核心作用����。目前還沒有批準(zhǔn)任何藥物療法用于治療NASH,因此探究NASH的發(fā)展機(jī)制�����,尋找潛在的治療靶點(diǎn)至關(guān)重要�����。
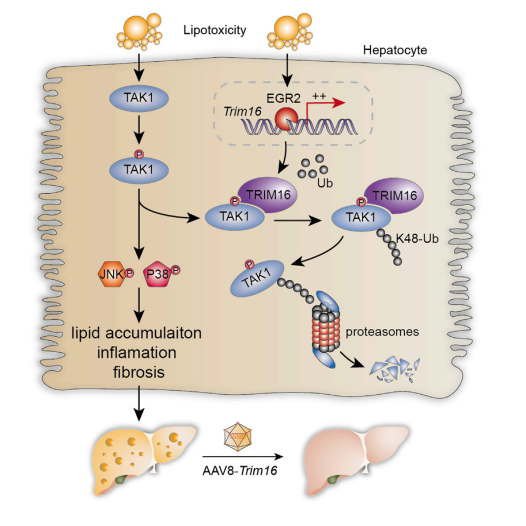
在本研究中����,為了確定減輕脂毒性有害后果的關(guān)鍵分子,作者進(jìn)行了綜合多組學(xué)分析����,確定了E3連接酶TRIM16為候選分子,進(jìn)一步分析發(fā)現(xiàn)TRIM16在脂毒性反應(yīng)中顯著上調(diào)�,并且過表達(dá)TRIM16(AAV8腹腔注射)減輕了NASH小鼠模型的脂質(zhì)積累和肝損傷����。同時(shí),作者還闡明了TRIM16調(diào)控NASH的機(jī)制�����,即TRIM16通過優(yōu)先與磷酸化的TGF-β活化激酶 1 (TAK1) 相互作用并通過催化K48連接的泛素化促進(jìn)其降解��,來減弱絲裂原活化蛋白激酶 (MAPK)信號(hào)通路的激活�,進(jìn)而抑制NASH的發(fā)展����?�?偟膩碚f���,該研究表明TRIM16是一種特定的TAK1調(diào)節(jié)器��,可以在NASH中作為潛在的治療靶標(biāo)����。
圖1. TRIM16調(diào)控NASH機(jī)制
|
病毒產(chǎn)品
|
AAV8-CMV-TRIM16&AAV8-CMV-GFP
|
|
實(shí)驗(yàn)動(dòng)物
|
8周齡HFHC喂養(yǎng)C57BL/6J 小鼠(NASH小鼠模型)
|
|
注射方式
|
腹腔注射
|
|
病毒滴度
|
1x10E13vg/ml
|
|
檢測(cè)時(shí)間
|
8周后
|
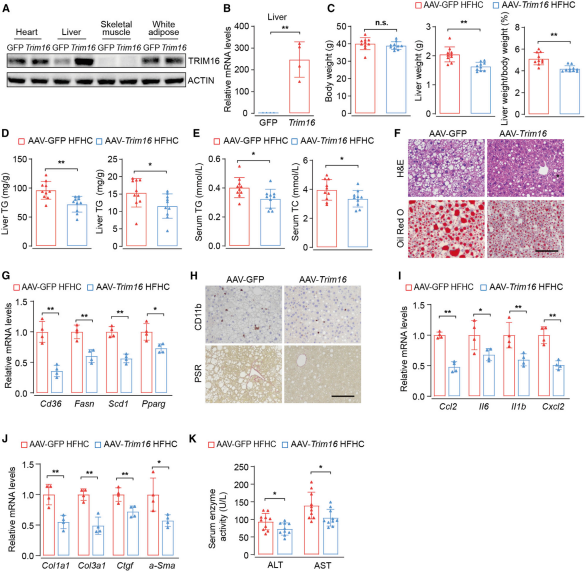
如圖2所示���,AAV8-TRIM16注射后�����,Western blot和qPCR分析均表明TRIM16在小鼠肝臟中過表達(dá)成功。與對(duì)照組(AAV-GFP)相比�,注射AAV8-TRIM16的小鼠在經(jīng)HFHC喂養(yǎng)16周后,肝臟重量和肝體重比明顯降低����,此外,TRIM16過表達(dá)顯著減緩了HFHC喂養(yǎng)小鼠肝臟中的脂質(zhì)積聚、炎癥��、纖維化和肝損傷�。
圖2. AAV8過表達(dá)TRIM16可減輕HFHC喂養(yǎng)小鼠的肝脂肪變性和炎癥
【點(diǎn)擊查看原文】
02
Overexpression of ring fnger protein 20 inhibits the progression of liver fbrosis via mediation of histone H2B lysine 120 ubiquitination
肝纖維化是一種慢性肝損傷��,可導(dǎo)致肝硬化和肝癌�。RNF20(環(huán)指蛋白20)又稱E3泛素蛋白連接酶BRE1A��,已被報(bào)道參與慢性肝病��,然而�,RNF20在肝纖維化中的作用尚不清楚。研究人員先后通過肝纖維化模型的體內(nèi)外研究證實(shí)�����,RNF20過表達(dá)可顯著抑制體內(nèi)外肝纖維化的進(jìn)展���,表明RNF20有望成為治療肝纖維化的新靶點(diǎn)。
|
病毒產(chǎn)品
|
AAV8-TBG-RNF20
|
|
實(shí)驗(yàn)動(dòng)物
|
C57BL/6J小鼠
|
|
注射方式
|
尾靜脈注射
|
|
病毒滴度
|
7.94×10E13 vg/ml
|
|
注射量
|
1×10E9pfu/mouse
|
|
檢測(cè)時(shí)間
|
8周后
|
為探究RNF20在肝纖維化中的作用��,研究人員建立了活體肝纖維化模型�,如圖3所示,使用AAV8過表達(dá)RNF20顯著逆轉(zhuǎn)了小鼠肝組織中由CCl4引起的炎性浸潤和膠原體積�,同時(shí)逆轉(zhuǎn)CCl4導(dǎo)致的α-SMA的表達(dá)增加和H2BK120ub蛋白水平的降低,這些結(jié)果表明�����,RNF20過表達(dá)可明顯減輕體內(nèi)肝纖維化癥狀����。
圖3. RNF20過表達(dá)可明顯緩解體內(nèi)肝纖維化癥狀
【點(diǎn)擊查看原文】
03
PSMP/MSMP promotes hepatic fibrosis through CCR2 and represents a novel therapeutic target
肝纖維化是一種慢性肝損傷的傷口愈合反應(yīng)����,其特征是細(xì)胞外基質(zhì)(ECM)在肝臟過度沉積��,最終導(dǎo)致肝功能喪失和肝臟結(jié)構(gòu)破壞�����。研究表明����,趨化因子受體系統(tǒng)在肝臟疾病的發(fā)病機(jī)制中起著關(guān)鍵作用,C-C基序趨化因子受體2(CCR2)被認(rèn)為是治療肝纖維化很有前景的一個(gè)靶點(diǎn)�。PC3分泌微蛋白(PSMP)/微精原蛋白(MSMP)是一種新型的趨化細(xì)胞因子,作為CCR2配體可以募集外周血單核細(xì)胞和淋巴細(xì)胞����,可能影響炎癥和癌癥的發(fā)展。
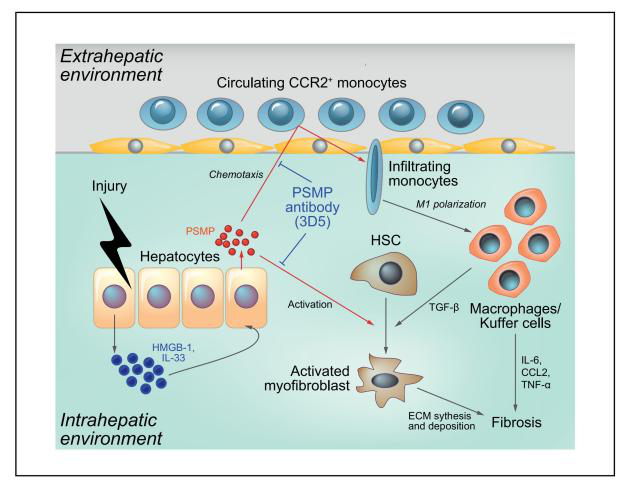
首先�,研究者通過免疫組織化學(xué)檢測(cè)了不同肝臟疾病組織中的PSMP水平,發(fā)現(xiàn)PSMP在肝纖維化患者肝組織中表達(dá)較高����。接著�,構(gòu)建了PSMP敲除小鼠(PSMP-/-小鼠),發(fā)現(xiàn)PSMP-/-小鼠血清丙氨酸轉(zhuǎn)氨酶(ALT)水平明顯降低,肝損傷得到改善���。利用AAV8載體在PSMP-/-小鼠過表達(dá)hPSMP�,發(fā)現(xiàn)肝損傷和纖維化顯著加重�����;并通過構(gòu)建PSMP和CCR2雙敲除小鼠模型發(fā)現(xiàn)PSMP過表達(dá)以CCR2依賴的方式促進(jìn)肝纖維化的發(fā)展�。作者揭示了PSMP通過促進(jìn)炎癥巨噬細(xì)胞浸潤�����、M1極化、促炎細(xì)胞因子產(chǎn)生以及通過CCR2直接激活肝星狀細(xì)胞進(jìn)而加速肝纖維化���,提出PSMP可能是一個(gè)潛在的肝纖維化治療靶點(diǎn)����,其抗體可能是治療肝纖維化的潛在藥物����。
圖4. PSMP/MSMP通過CCR2促進(jìn)肝纖維化
|
基因信息
|
hPSMP(人類PC3分泌型微蛋白�����,一種新型的趨化細(xì)胞因子����,受體為CCR2)
|
|
病毒產(chǎn)品
|
AAV8-hPSMP&AAV8-null
|
|
實(shí)驗(yàn)動(dòng)物
|
6-8周齡C57BL/6J雄性小鼠
|
|
注射方式
|
尾靜脈注射
|
|
注射劑量
|
100μL���,2×10E11vg
|
|
檢測(cè)時(shí)間
|
8周后
|
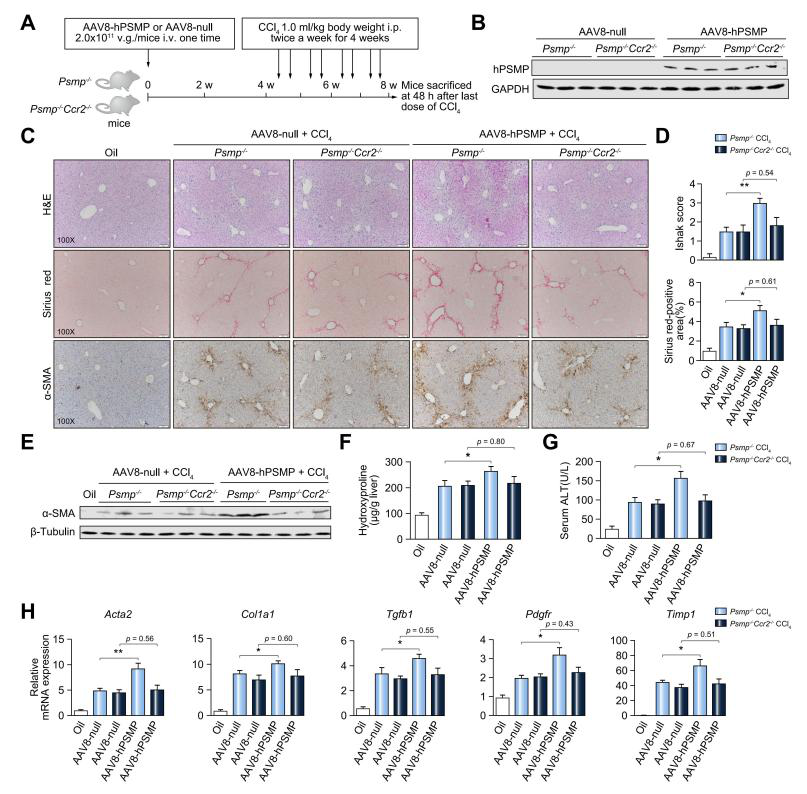
通過尾靜脈注射AAV8-hPSMP后,PSMP-/-小鼠肝臟PSMP表達(dá)量顯著升高�����,注射4周后PSMP依舊有較高的表達(dá)。接著再用CCl4處理以誘導(dǎo)肝纖維化����,發(fā)現(xiàn)PSMP過表達(dá)引起的肝損傷和纖維化顯著加重,并通過構(gòu)建PSMP和CCR2雙敲除小鼠模型發(fā)現(xiàn)PSMP過表達(dá)以CCR2依賴的方式促進(jìn)肝纖維化的發(fā)展����。
圖5. AAV8過表達(dá)PSMP對(duì)CCl4誘導(dǎo)小鼠肝纖維化的影響
【點(diǎn)擊查看原文】
04
Hepatic neddylation targets and stabilizes electron transfer flavoproteins to facilitate fatty acid β-oxidation
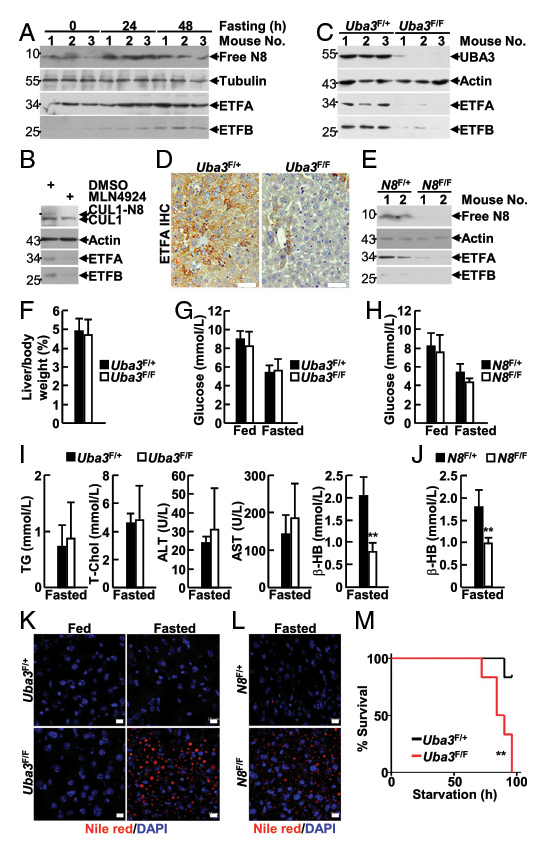
類泛素化修飾(Neddylation)是一種通過將NEDD8與特定底物蛋白中的賴氨酸共價(jià)結(jié)合����,控制細(xì)胞的生存和增殖的泛素化樣途徑。但是��,類泛素化在哺乳動(dòng)物代謝中的生理作用尚不明確�����,也沒有明確的線粒體靶點(diǎn)��。肝臟特異性UBA3缺乏會(huì)導(dǎo)致類似戊二酸尿癥II型(GA-II)的系統(tǒng)性異常�����,GA-II是一種罕見的常染色體隱性遺傳性脂肪酸氧化障礙疾病�����,由線粒體電子轉(zhuǎn)移黃素蛋白(ETF:ETFA和ETFB)或相應(yīng)的泛醌氧化還原酶缺陷引起��。然而ETFA和ETFB蛋白水平在轉(zhuǎn)錄后水平調(diào)控的機(jī)制尚不清楚�����。
在本研究中��,作者構(gòu)建的肝臟特異性UBA3和NEDD8缺失的小鼠模型���,表現(xiàn)出自發(fā)性脂肪肝和肝細(xì)胞衰老的新生兒死亡,并伴有肝臟脂肪酸-β氧化缺陷�����;成年小鼠中UBA3的特異性缺失(通過AAV-DJ進(jìn)行尾靜脈注射)導(dǎo)致ETF蛋白的減少�,并增加禁食誘導(dǎo)的脂肪變性和死亡率。IB和IF分析發(fā)現(xiàn)新生小鼠線粒體蛋白也發(fā)生類泛素化��,免疫共沉淀分析發(fā)現(xiàn)ETF蛋白為類泛素化的底物。此外�����,ETF基因突變導(dǎo)致類泛素化修飾缺陷,促進(jìn)了GA-II的發(fā)病��。本研究表明類泛素化修飾是一種可以通過阻斷肝細(xì)胞內(nèi)ETFs的泛素化和降解來靶向并穩(wěn)定ETFs的泛素化樣修飾途徑���,肝類泛素化可防止新生小鼠出現(xiàn)GA-II類異常�,降低成年小鼠因禁食引起的死亡率�。
|
病毒產(chǎn)品
|
AAV-DJ-CAG-Cre
|
|
實(shí)驗(yàn)動(dòng)物
|
8周齡C57BL/6J雄性小鼠
|
|
注射方式
|
尾靜脈注射
|
|
注射量
|
20 μL
|
|
病毒滴度
|
3.0×10E13vg/ml
|
|
檢測(cè)時(shí)間
|
6周后
|
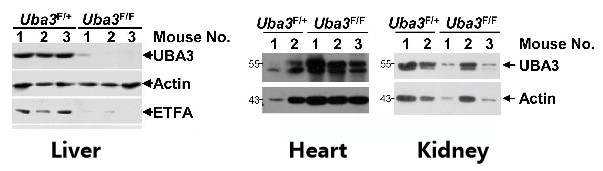
如圖6A所示�,研究人員將AAV-DJ-CAG-Cre通過尾靜脈注射至8周齡雄性Uba3F/F和同窩Uba3F/+ 小鼠體內(nèi),IB分析證實(shí)Uba3F/F小鼠肝臟中UBA3缺失���,但心臟和腎臟中沒有���,證明肝臟特異性UBA3缺失小鼠模型構(gòu)建成功。經(jīng)AAV-DJ-Cre轉(zhuǎn)導(dǎo)后����,Uba3F/F小鼠和Nedd8F/F小鼠肝臟中UBA3��、Nedd8的缺失導(dǎo)致ETFs蛋白表達(dá)水平的顯著下降;對(duì)小鼠進(jìn)行禁食處理�����,研究者發(fā)現(xiàn)UBA3���、Nedd8的缺失導(dǎo)致小鼠肝臟脂質(zhì)儲(chǔ)存和死亡率增加����,表明成年小鼠肝臟中的類泛素化/ETF軸可以預(yù)防禁食誘導(dǎo)的脂肪變性和死亡率���。
圖6A. 構(gòu)建肝臟特異性UBA3缺失小鼠模型
圖6B. 類泛素化/ETF軸可以預(yù)防成年小鼠肝臟中由禁食誘導(dǎo)的脂肪變性和死亡率
【點(diǎn)擊查看原文】
05
Suppression of YAP/TAZ-Notch1-NICD axis by bromodomain and extraterminal protein inhibition impairs liver regeneration
肝臟有很強(qiáng)的再生能力�,許多肝臟疾病的治療都是通過有效的肝再生來調(diào)節(jié)的。但是��,調(diào)控肝再生的生物學(xué)機(jī)制仍不清楚。研究表明����,溴域和末端外結(jié)構(gòu)域(BET)蛋白及其抑制劑與肝癌密切相關(guān),此外BET蛋白在斑馬魚的肝再生過程中至關(guān)重要���,但具體的機(jī)制仍需進(jìn)一步探究���。Hippo-YAP/TAZ通路已被證實(shí)是調(diào)節(jié)細(xì)胞增殖和器官大小的關(guān)鍵因子���,在多種肝疾病中處于激活狀態(tài)���,但其是否參與肝再生過程也尚不明確。
在本研究中���,作者發(fā)現(xiàn)BET蛋白抑制劑JQ1顯著抑制70%肝臟切除術(shù)(PH)后的肝再生��,并且JQ1可以抑制肝臟細(xì)胞的增殖。進(jìn)一步檢測(cè)發(fā)現(xiàn)JQ1在mRNA和蛋白水平抑制體內(nèi)肝再生過程YAP/YAZ和Notch信號(hào)通路的表達(dá)����,而YAP/TAZ抑制劑顯著下調(diào)了YAP、TAZ和Notch信號(hào)通路相關(guān)基因的表達(dá)����,并抑制70%PH后肝再生。接著利用AML12-Yap-shRNA細(xì)胞系證明了JQ1可以通過抑制AML12細(xì)胞YAP的表達(dá)��,間接下調(diào)Notch信號(hào)通路的活性���,下游分子Notch1被證明是YAP/TAZ的功能靶標(biāo)��。最后發(fā)現(xiàn)通過過表達(dá)YAP可以補(bǔ)救BET蛋白抑制劑引起的肝再生損傷���,揭示了YAP/TAZ–Notch1–NICD在肝再生中的功能以及BET蛋白抑制劑(如JQ1)在肝臟疾病治療中的風(fēng)險(xiǎn)。
|
基因信息
|
YAP(Hippo/Yes-associated protein��,Hippo/Yes相關(guān)蛋白����,被認(rèn)為是調(diào)控肝臟大小的重要因子)
|
|
病毒產(chǎn)品
|
AAV9-CMV-YAP
|
|
實(shí)驗(yàn)動(dòng)物
|
6周齡C57BL/6J雄性小鼠
|
|
注射方式
|
腹腔注射
|
|
注射劑量
|
1×10E11 vg/mice
|
|
檢測(cè)時(shí)間
|
4周后
|
腹腔注射表達(dá)YAP的AAV9過表達(dá)載體,發(fā)現(xiàn)YAP顯著高表達(dá)����。與YAP非過表達(dá)組相比,YAP過表達(dá)后小鼠LW/BW比���、肝再生的兩個(gè)關(guān)鍵調(diào)節(jié)因子Hgf和Vegf表達(dá)水平及Notch信號(hào)通路相關(guān)蛋白(Jagged1, Notch1和NICD)表達(dá)水平均明顯升高。不僅如此��,Ki-67(細(xì)胞增殖指數(shù))陽性肝細(xì)胞數(shù)量也遠(yuǎn)遠(yuǎn)高于YAP非過表達(dá)組���。這些數(shù)據(jù)說明���,小鼠肝臟中YAP的過表達(dá)可以挽救BET蛋白抑制劑對(duì)肝再生的損傷���。
圖7. AAV9過表達(dá)Yap可補(bǔ)救BET蛋白抑制劑引起的肝再生損傷
【點(diǎn)擊查看原文】