AAV在胰腺研究中的靶向策略(干貨&應(yīng)用合集)
胰腺是重要的分泌器官�,由外分泌組織(腺泡)����、內(nèi)分泌組織(胰島)、胰管和血管組成�����,這些結(jié)構(gòu)的功能障礙會(huì)導(dǎo)致不同的胰腺疾病發(fā)生��。鑒于胰腺的解剖位置和復(fù)雜結(jié)構(gòu)��,胰腺疾病的基因治療需要針對(duì)不同胰腺部位進(jìn)行有效的基因傳遞�����。多項(xiàng)研究表明����,相比腺病毒和慢病毒而言�,腺相關(guān)病毒更能有效轉(zhuǎn)導(dǎo)胰腺��,已作為一種明星載體在胰腺研究中展開應(yīng)用�����。今天小V就帶大家一起學(xué)習(xí)一下rAAV在胰腺基因工程中的選擇策略���。
一、血清型的選擇
研究表明AAV8在胰腺中具有相對(duì)較高的轉(zhuǎn)導(dǎo)效率�。
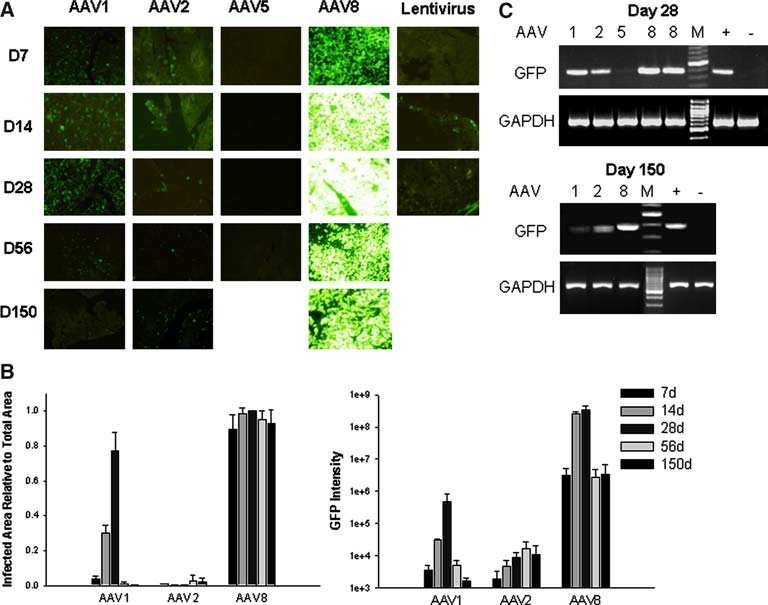
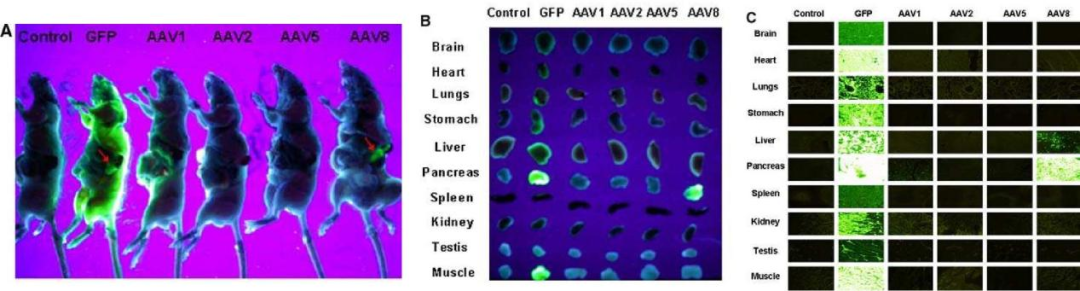
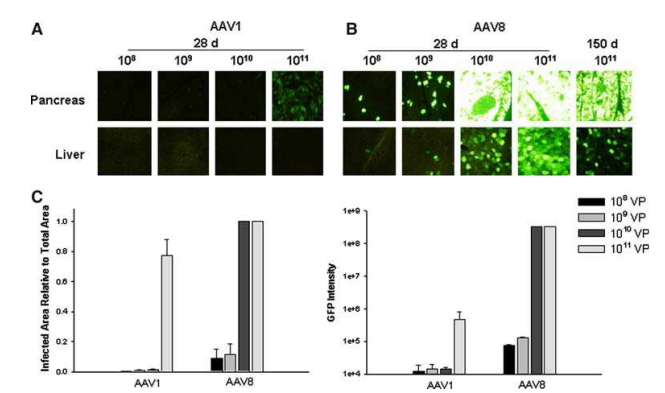
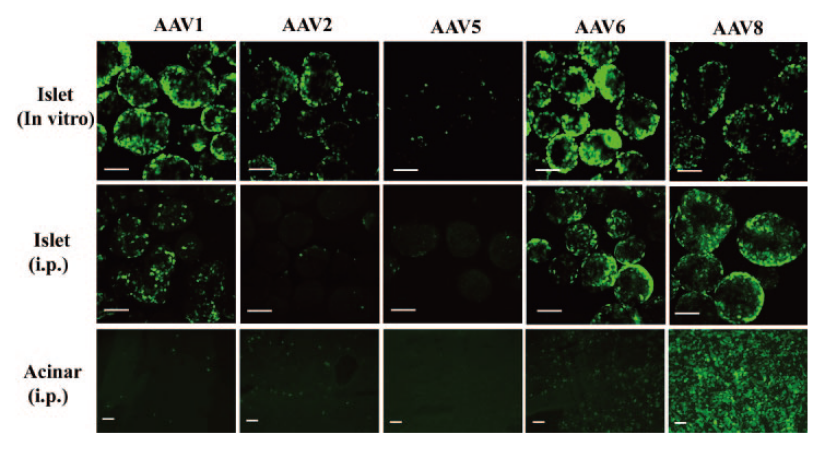
Cheng H等研究證明�����,AAV8對(duì)胰腺的轉(zhuǎn)導(dǎo)效率優(yōu)于AAV1、AAV2��、AAV5血清型,且持續(xù)表達(dá)時(shí)間較長(圖1)����;進(jìn)一步通過胰腺導(dǎo)管給藥觀察不同血清型的組織分布發(fā)現(xiàn)AAV8可以高效轉(zhuǎn)導(dǎo)胰腺組織(圖2),并且轉(zhuǎn)導(dǎo)效率呈劑量依賴式增加(圖3)�。
圖1.不同AAV血清型和慢病毒對(duì)胰腺的轉(zhuǎn)導(dǎo)效率比較
病毒:ssAAV1���、2、5��、8�,LV
啟動(dòng)子:CMV
注射量:AAV:1011 VP���;LV:1.5×107 IU
注射方法:胰腺導(dǎo)管給藥
(Cheng, H., et al. J Biomed Sci, 2007.)
圖2. 不同血清型AAV經(jīng)胰腺局部給藥后的組織分布
病毒:ssAAV1����、2�、5、8
啟動(dòng)子:CMV
注射量:1011 VP
注射方法:胰腺導(dǎo)管給藥
(Cheng, H., et al. J Biomed Sci, 2007.)
圖3. AAV1和AAV8對(duì)胰腺轉(zhuǎn)導(dǎo)的劑量反應(yīng)
病毒:ssAAV1���、8
啟動(dòng)子:CMV
注射量:108-1011 VP
注射方法:胰腺導(dǎo)管給藥
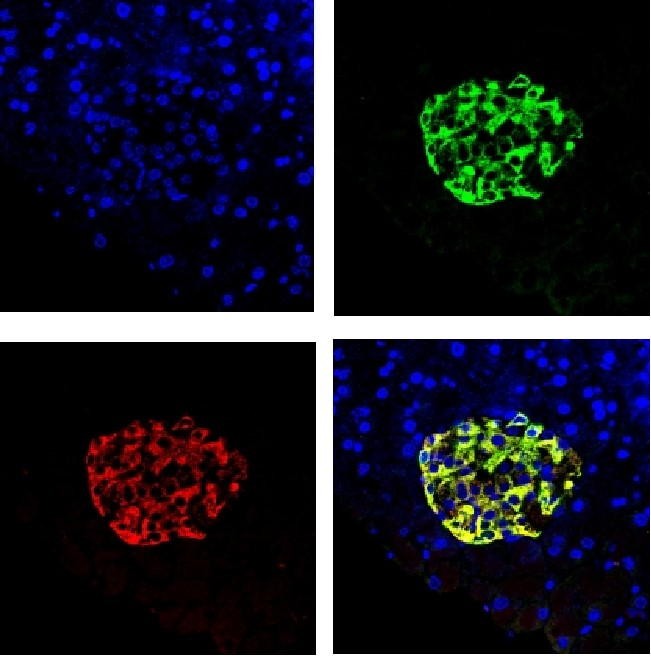
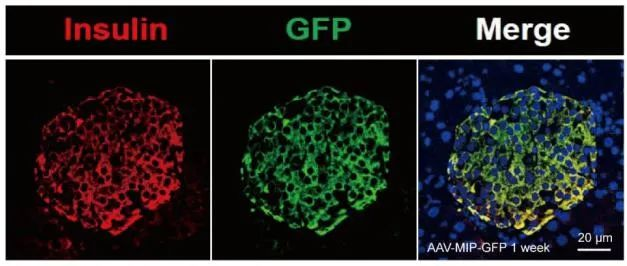
· 維真AAV8感染小鼠胰腺效果圖 ·
(Insulin:紅色熒光 GFP:綠色熒光)
病毒產(chǎn)品:AAV8-insulin-GFP
病毒用量:1012 vg
注射方法:膽總管(十二指腸壺腹開口處)
二�����、AAV載體的選擇
研究表明scAAV對(duì)胰腺的轉(zhuǎn)導(dǎo)效率也較高�,且不同血清型轉(zhuǎn)導(dǎo)效率與給藥方式、啟動(dòng)子和注射量等密切相關(guān)��。體外感染分離的胰島時(shí)�,scAAV6的感染能力強(qiáng)于scAAV1���、scAAV2和scAAV8;通過全身給藥時(shí)(腹腔體內(nèi)注射)���,scAAV8比scAAV6轉(zhuǎn)導(dǎo)效率強(qiáng)(圖5)�����;而通過胰腺導(dǎo)管給藥時(shí)��,scAAV6強(qiáng)于scAAV8�、9�,可以有效轉(zhuǎn)導(dǎo)腺泡�、導(dǎo)管�、胰島在內(nèi)的多種胰腺細(xì)胞(圖6)。
圖5.不同血清型dsAAV-CB-GFP載體對(duì)體外胰島和體內(nèi)胰腺的轉(zhuǎn)導(dǎo)效率比較
病毒:scAAV1��、2��、5���、6�、8
啟動(dòng)子:CB
注射量:5×1011VG
注射方法:腹腔注射
(Wang, Z., et al. Diabetes, 2006.)
圖6.胰腺導(dǎo)管給藥時(shí),scAAV6轉(zhuǎn)導(dǎo)效率強(qiáng)于scAAV8�����、9
病毒:scAAV6��、8��、9
啟動(dòng)子:EF1α
注射量:1×1011VG
注射方法:胰腺導(dǎo)管給藥
(Quirin, K.A., et al.Mol Ther Methods Clin Dev, 2018.)
三��、啟動(dòng)子的選擇
為了在胰腺特定細(xì)胞中實(shí)現(xiàn)AAV介導(dǎo)的轉(zhuǎn)基因表達(dá)����,可以選擇胰腺組織特異性啟動(dòng)子����,目前文獻(xiàn)中推薦的啟動(dòng)子是胰腺β細(xì)胞特異性啟動(dòng)子Insulin和PDX1����,可以有效介導(dǎo)基因在胰腺β細(xì)胞的特異表達(dá)。
四���、注射方式的選擇
在胰腺研究中,常用的給藥方有腹腔注射�����、靜脈注射和胰腺導(dǎo)管內(nèi)注射���。不同給藥方式會(huì)影響AAV載體對(duì)細(xì)胞的轉(zhuǎn)導(dǎo)能力���。研究表明,與導(dǎo)管內(nèi)給藥相比����,ssAAV8和ssAAV9載體對(duì)胰腺的系統(tǒng)性給藥會(huì)導(dǎo)致其轉(zhuǎn)導(dǎo)率降低.(參考文獻(xiàn)“Safety and Efficacy of AAV Retrograde Pancreatic D)
因此,根據(jù)實(shí)驗(yàn)?zāi)康倪x擇合適的注射方式十分重要�����。系統(tǒng)性給藥方式(腹腔注射和靜脈注射)的操作方式不再贅述���,在此介紹一下胰腺導(dǎo)管內(nèi)注射的操作方式(僅供參考):
1、將小鼠進(jìn)行麻醉后手術(shù)打開其腹腔�,在膽囊底部切一小口�����,將特定的導(dǎo)管插入膽囊管中���;
2���、將導(dǎo)管置入總膽管,并在膽管和導(dǎo)管周圍用微鉗夾固定�,以防止載體反流進(jìn)入肝臟;
3�����、將微鉗夾置于Oddi括約肌上���,避免載體漏入十二指腸,將100μl AAV載體通過導(dǎo)管緩慢注入胰管�����,腺體均勻腫脹則證明給藥成功�;
4�、灌注5min后取下上述兩個(gè)微鉗夾;
5����、取出導(dǎo)管,手術(shù)縫合小鼠腹腔傷口���。
6�、術(shù)后�,將小鼠放置在加熱墊上待其恢復(fù)后放回籠子��。
· 總結(jié) ·
在胰腺研究中�,不同AAV血清型轉(zhuǎn)導(dǎo)效率與AAV載體選擇、啟動(dòng)子以及給藥方式等因素密切相關(guān):
①通過胰腺導(dǎo)管給藥方式���,ssAAV8比ssAAV1、ssAAV2��、ssAAV5轉(zhuǎn)導(dǎo)效率強(qiáng)�;
②通過全身給藥�,scAAV8比scAAV6轉(zhuǎn)導(dǎo)效率強(qiáng);通過胰腺導(dǎo)管給藥方式時(shí)����,scAAV6強(qiáng)于scAAV8、9�����;
③ssAAV8、9經(jīng)胰腺導(dǎo)管給藥比經(jīng)全身給藥轉(zhuǎn)導(dǎo)效率強(qiáng)�����。
小V建議您實(shí)驗(yàn)前根據(jù)實(shí)驗(yàn)?zāi)康木C合選擇合適的載體�����、血清型�、啟動(dòng)子和注射方式,以實(shí)現(xiàn)基因的高效長久表達(dá)���。
客戶案例分享1
“Autotaxin signaling facilitates b cell dedifferentiation and dysfunction induced by Sirtuin 3 deficiency”(IF=6.448)
外周組織β細(xì)胞功能缺陷和胰島素抵抗是2型糖尿?����。═2D)的主要病理生理學(xué)特征�����。β細(xì)胞去分化是導(dǎo)致β細(xì)胞功能缺陷進(jìn)而促進(jìn)T2D進(jìn)展的因素之一�。研究表明���,控制β細(xì)胞去分化可作為改善β細(xì)胞功能的一種潛在治療策略��。此外�����,多項(xiàng)研究證實(shí)胰島中SIRT3蛋白的表達(dá)與β細(xì)胞功能障礙密切相關(guān)��。
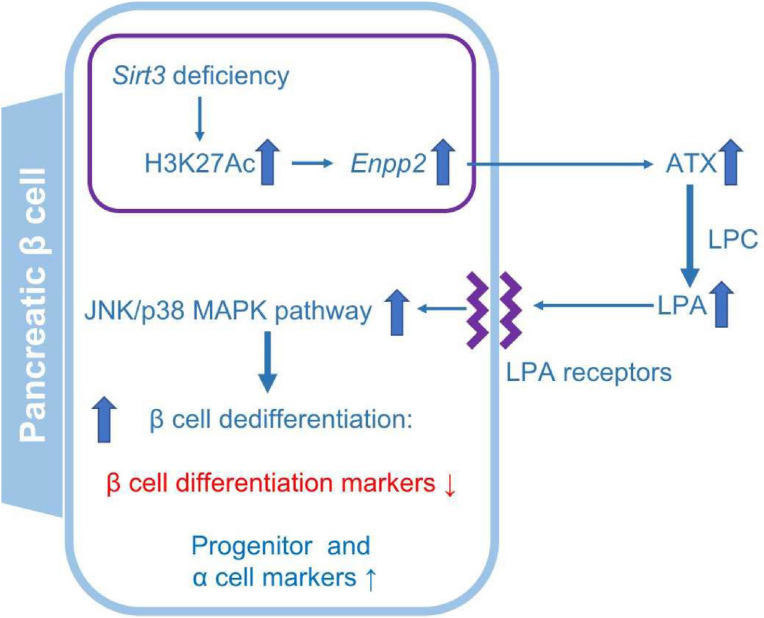
先前的研究已發(fā)現(xiàn)�����,β細(xì)胞Sirt3特異性敲除的小鼠在HFD喂食后�����,糖耐量和胰島素分泌受損�;胰島Sirt3缺失后Enpp2(又稱ATX)蛋白表達(dá)增強(qiáng),Enpp2/ATX是一種具有溶血磷脂酶活性的分泌酶����,可產(chǎn)生溶血磷脂酸(LPA)�。在此研究中,作者假設(shè)ATX/LPA通路的激活促進(jìn)了Sirt3缺陷β細(xì)胞的去分化��,并將LPA或LPC(ATX可將其水解產(chǎn)生LPA)應(yīng)用于Sirt3缺失的MIN6細(xì)胞系和小鼠胰島,以研究LPA對(duì)β細(xì)胞去分化的影響及其潛在機(jī)制��。
研究顯示在Sirt3缺失的MIN6細(xì)胞和小鼠胰島中����,ATX表達(dá)上調(diào)導(dǎo)致LPC增加,進(jìn)而使LPA產(chǎn)生增加����。LPA的增加不僅誘導(dǎo)了MIN6細(xì)胞和小鼠胰島的可逆去分化,而且還減少了葡萄糖刺激的胰島素分泌��。機(jī)制上�,ATX/LPA通過誘導(dǎo)JNK/p38 MAPK磷酸化促進(jìn)β細(xì)胞脫分化。使用AAV8體內(nèi)抑制ATX(AAV8-Atx-shRNA)可以改善HFD喂養(yǎng)的Sirt3缺失小鼠的胰島素分泌并減少β細(xì)胞的去分化�。
圖7. Sirt3-ATX/LPA通路在胰腺β細(xì)胞去分化中的作用機(jī)制
基因信息:Atx���,外核苷酸焦磷酸酶/磷酸二酯酶蛋白家族成員
病毒產(chǎn)品:AAV8-Atx-shRNA����、AAV8-scramble(insulin 1啟動(dòng)子)
實(shí)驗(yàn)動(dòng)物:8周齡雄性小鼠
注射方式:腹腔注射
注射量:1×1012 genome copies
注射體積:100 μL
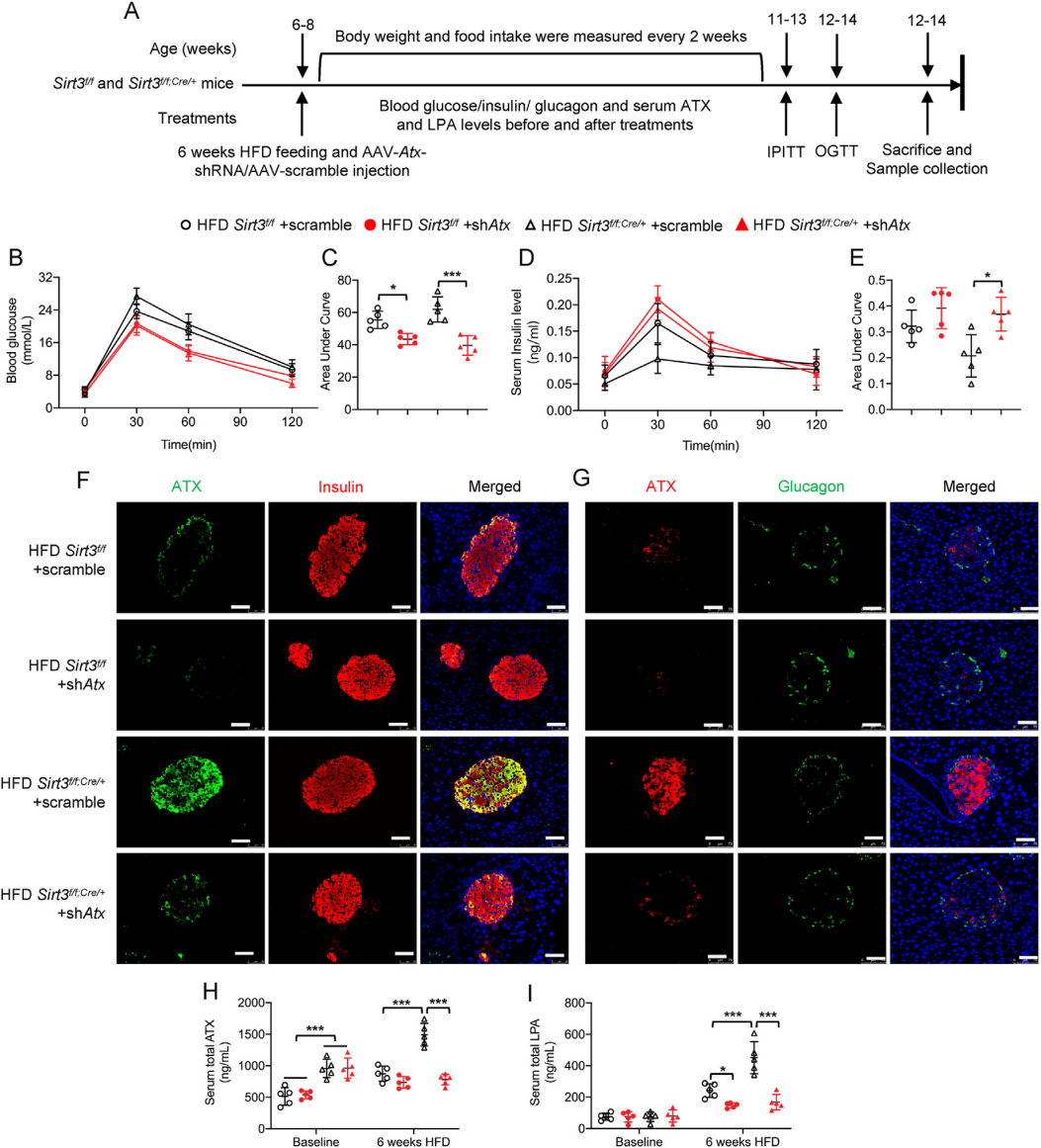
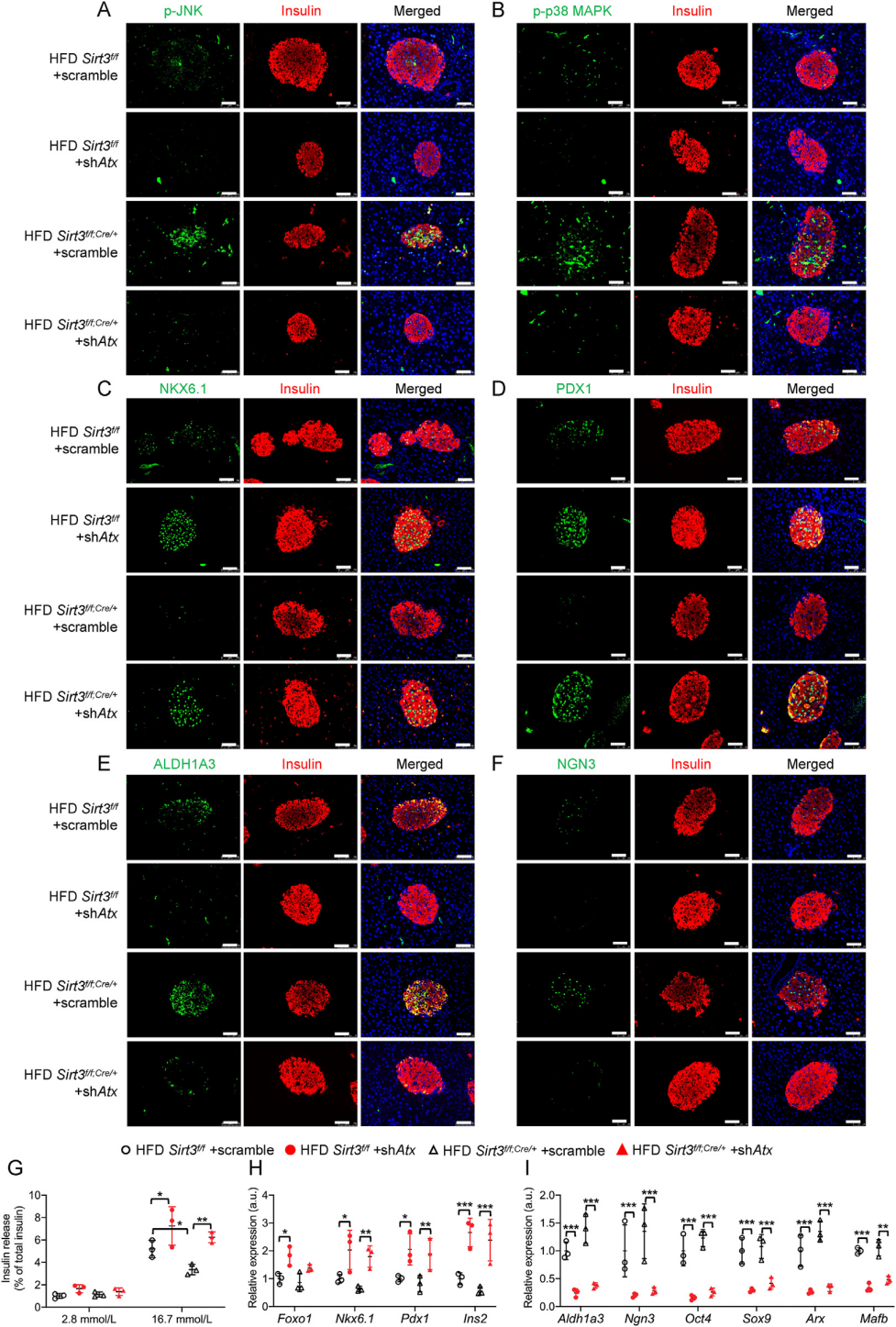
研究者使用腺相關(guān)病毒載體AAV8選擇性抑制了ATX在正常小鼠和Sirt3 f/f;Cre/+小鼠胰島中的表達(dá)���。病毒注射8周后�����,進(jìn)行6周的HFD喂食����。胰島ATX蛋白水平的降低證明了AAV8病毒的有效傳遞����。隨后的多項(xiàng)實(shí)驗(yàn)測試表明胰臟β細(xì)胞中ATX的敲低不僅可以挽救HFD誘導(dǎo)的葡萄糖耐受不良�����,恢復(fù)胰島素的分泌���,還減弱了HFD誘導(dǎo)的Sirt3 f/f;Cre/+小鼠中JNK/p38 MAPK信號(hào)的激活��,抑制β細(xì)胞的去分化���。這些結(jié)果證實(shí)了ATX在體內(nèi)對(duì)β細(xì)胞去分化的病理作用��。
圖8. Sirt3 f/f;Cre/+小鼠ATX的特異性敲低改善了HFD誘導(dǎo)的葡萄糖耐受不良
圖9. Sirt3 f/f;Cre/+小鼠ATX的特異性敲低改善了HFD誘導(dǎo)的β細(xì)胞去分化
案例分享2
“HRD1 an important player in pancreatic β-cell failure and therapeutic target for type 2 diabetic mice”(IF=9.461)
2型糖尿病(T2D)是一種以血糖持續(xù)升高為特征的慢性代謝性疾病�����,研究報(bào)道胰臟β細(xì)胞衰竭導(dǎo)致的胰島素分泌不足與T2D的發(fā)生發(fā)展密切相關(guān)�。HRD1 (HMG-CoA reductase degradation 1)���,是內(nèi)質(zhì)網(wǎng)應(yīng)激相關(guān)E3泛素連接酶的代表��,通過靶向并有效降解錯(cuò)誤折疊的胰島素原維持胰島β細(xì)胞的功能,HRD1的缺失會(huì)導(dǎo)致胰島素分泌(GSIS)受損�。研究報(bào)道HRD1在 Akita糖尿病小鼠胰島中表達(dá)上調(diào)。NCBI GEO數(shù)據(jù)庫的基因組數(shù)據(jù)顯示��,T2D患者胰島細(xì)胞HRD1 mRNA水平升高��。然而�,HRD1在胰島β細(xì)胞中的特異性病理作用仍不明確����。
大量的β細(xì)胞轉(zhuǎn)錄因子在成熟β細(xì)胞功能的維持中起著至關(guān)重要的作用,其中��,轉(zhuǎn)錄因子v-maf 肌腱膜纖維肉瘤癌基因同源物A(MafA)僅在胰腺β細(xì)胞中表達(dá)���,是β細(xì)胞形成和功能所需的關(guān)鍵因子�。盡管泛素誘導(dǎo)的降解是糖尿病條件下β細(xì)胞中MafA減少的主要原因����,但E3泛素連接酶在調(diào)節(jié)MafA活性中的具體作用仍有待探索。
在本研究中��,研究者發(fā)現(xiàn)HRD1在T2D病人和T2D小鼠胰島中過度表達(dá)����。功能研究表明��,β細(xì)胞HRD1的特異性過表達(dá)引發(fā)了胰島素分泌受損���,最終導(dǎo)致嚴(yán)重的高血糖;相反�����,在糖尿病模型中,HRD1基因的下調(diào)改善了血糖控制和反應(yīng)�����。蛋白質(zhì)組學(xué)分析表明HRD1與β細(xì)胞功能調(diào)控因子MafA可能存在相互作用。機(jī)制上���,HRD1作為E3泛素連接酶,在糖尿病β細(xì)胞中靶向MafA的泛素化和降解�����,導(dǎo)致細(xì)胞質(zhì)中MafA的積累���,并降低其在細(xì)胞核中的生物功能,進(jìn)一步導(dǎo)致β細(xì)胞功能障礙�。本研究揭示了HRD1可作為2型糖尿病的治療靶點(diǎn),確立了靶向HRD1對(duì)T2D治療的重要性��。
基因信息:HRD1
病毒產(chǎn)品:AAV8-MIP–shHRD1–GFP�、AAV8-MIP-HRD1-GFP����、AAV8-GFP-control
病毒滴度:1012 GCP/mL
注射方式:胰腺導(dǎo)管內(nèi)注射,6 μl/min
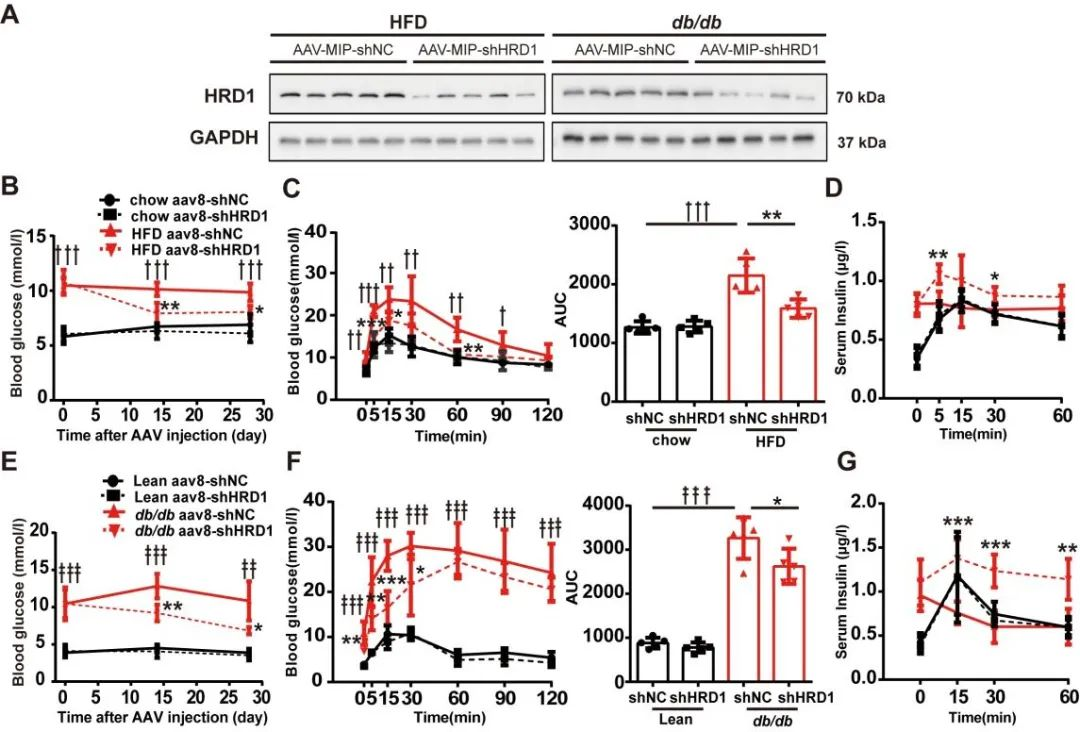
研究人員通過胰腺導(dǎo)管給藥AAV8-MIP-shHRD1-GFP��,注射入雄性C57BL / 6J小鼠胰腺導(dǎo)管�����,特異性敲低小鼠β細(xì)胞中的HRD1�����,免疫熒光證實(shí)了AAV載體在體內(nèi)的有效傳遞(圖10)��。
圖10. 胰腺導(dǎo)管給藥AAV在體內(nèi)的有效傳遞
隨后作者將AAV8-MIP-shHRD1注射入HFD飼喂的糖尿病小鼠胰腺導(dǎo)管���,2周后,糖尿病小鼠空腹血糖明顯下降�。4周后,糖耐量試驗(yàn)(Intraperitoneal Glucose Tolerance Test���,IPGTT)結(jié)果顯示糖尿病小鼠血糖反應(yīng)和血清胰島素水平明顯改善。AAV-shHRD1注射db/db小鼠的葡萄糖反應(yīng)也有改善��。綜上結(jié)果表明HRD1在胰島β細(xì)胞功能障礙和糖尿病中發(fā)揮重要作用����。
圖11. 抑制HRD1可改善糖尿病小鼠高血糖和葡萄糖耐受不良
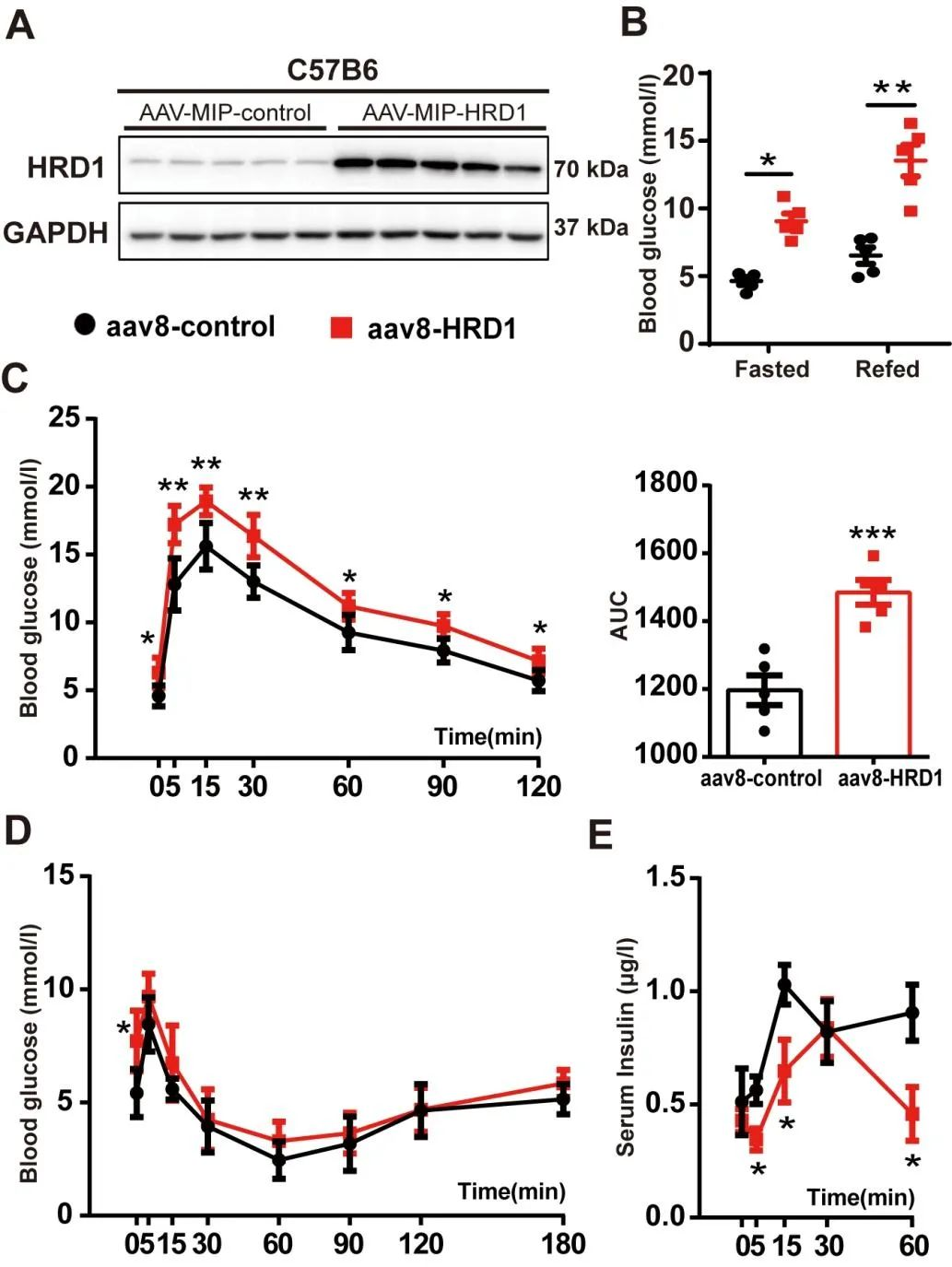
研究人員通過胰腺導(dǎo)管內(nèi)注射AAV8-MIP-HRD1,注射后胰島HRD1蛋白水平明顯升高,小鼠的空腹血糖和復(fù)餐血糖水平顯著升高���,獲得β細(xì)胞HRD1特異性過表達(dá)小鼠。IPGTT結(jié)果顯示糖代謝嚴(yán)重受損����,HRD1特異性過表達(dá)的小鼠血漿胰島素水平表現(xiàn)紊亂。上述結(jié)果表明β細(xì)胞HRD1上調(diào)可誘發(fā)高血糖并損傷胰島素的分泌�����。
圖12. HRD1過表達(dá)引發(fā)高血糖和葡萄糖耐受不良
案例分享 3
“Inhibition of miR-155 reduces impaired autophagy and improves prognosis in an experimental pancreatitis mouse model”(IF=8.469)
急性胰腺炎(AP)是一種胰腺炎癥疾病,其特征是蛋白酶異常激活�、實(shí)質(zhì)損傷、胰腺自消化���、腺泡細(xì)胞凋亡和壞死以及強(qiáng)烈的炎癥反應(yīng)�����。AP的早期階段,胰腺的損傷和炎癥會(huì)引起全身炎癥反應(yīng)綜合征(SIRS)���,可導(dǎo)致單個(gè)或多個(gè)器官衰竭���,這也正是AP早期發(fā)病和死亡的主要原因�����。然而�,AP引起的器官衰竭的病理機(jī)制還尚未闡明�。
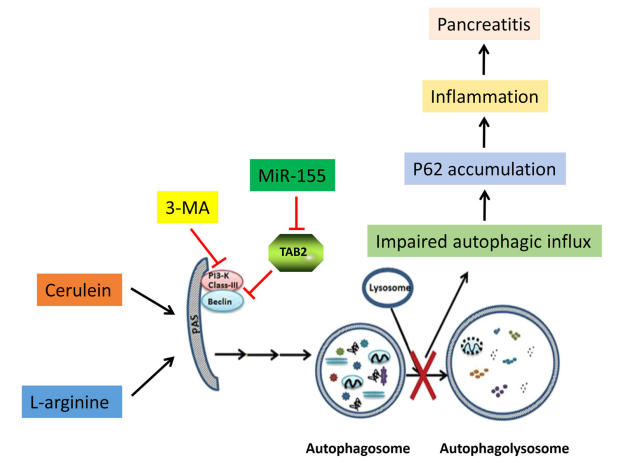
MiR-155是一種在炎癥反應(yīng)促進(jìn)和抗炎通路激活抑制中發(fā)揮重要作用的miRNA���,已有研究表明��,miR155在胰腺炎樣本中表達(dá)上調(diào)�����。已知自噬受損可促進(jìn)酶原激活、腺泡細(xì)胞分泌異常�、細(xì)胞死亡和炎癥反應(yīng)進(jìn)而加重AP;此外����,有研究表明miR-155在多種疾病中促進(jìn)自噬�。本研究旨在通過調(diào)節(jié)自噬探究miR-155對(duì)AP病程的影響���。
基因信息:miR-155
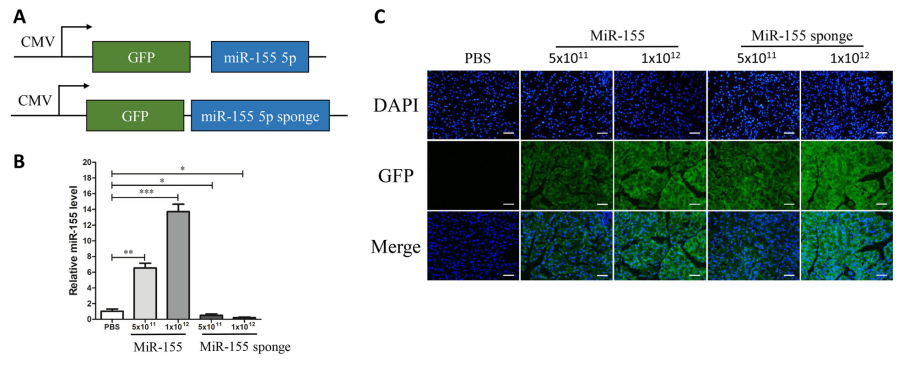
病毒產(chǎn)品:AAV9-miR-155、AAV9-miR-155 sponge
注射體積:病毒稀釋液50 μL
注射方式:尾靜脈注射
檢測時(shí)間:注射3周后
首先�����,本研究構(gòu)建了AP小鼠模型�,利用AAV9載體介導(dǎo)miR-155和miR-155 sponge在AP小鼠胰腺中進(jìn)行有效傳遞,發(fā)現(xiàn)miR-155靶蛋白TAB2的表達(dá)受到明顯調(diào)控���。此外���,miR-155表達(dá)的調(diào)節(jié)可以影響蛙皮素誘導(dǎo)的AP嚴(yán)重程度���,進(jìn)一步研究發(fā)現(xiàn)沉默miR-155可以抑制不能與溶酶體融合的自噬小體的積累,并通過靶向TAB2減少胰腺炎癥�,從而改善AP模型小鼠的胰腺和肺損傷。此外�����,自噬抑制劑3-MA可以減少自噬小體的異常積累���,從而減輕因miR-155水平升高而加重的胰腺損傷���。本研究表明調(diào)節(jié)miR-155的表達(dá)可能是治療或預(yù)防胰腺炎的一種潛在策略。
圖13. AP中miR-155和自噬的調(diào)節(jié)機(jī)制
研究者通過小鼠尾靜脈注射AAV介導(dǎo)的miR-155和miR-155 sponge����,3周后檢測miR-155的表達(dá)量����,發(fā)現(xiàn)AAV9介導(dǎo)的miR-155在胰腺中有效傳遞,并且高滴度的AAV9對(duì)miR-155的表達(dá)影響更為顯著(圖14)�。
圖14. AAV9介導(dǎo)的miR-155在胰腺中有效傳遞
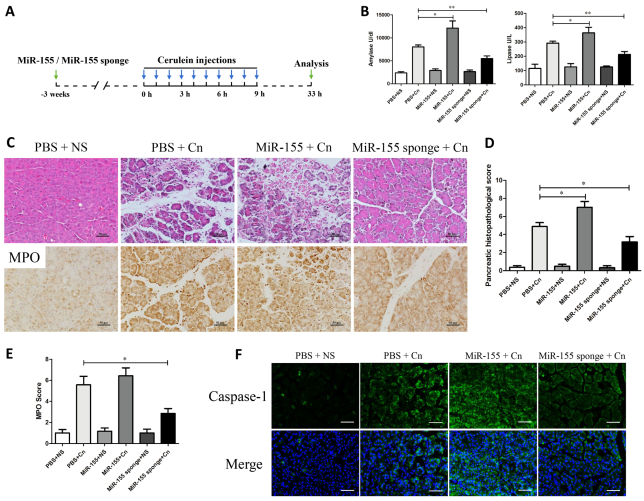
進(jìn)一步研究miR-155的調(diào)控對(duì)蛙皮素誘導(dǎo)的AP程度影響,通過胰腺水腫�����、炎癥細(xì)胞浸潤���、腺泡細(xì)胞的病理改變以及淀粉酶和脂肪酶水平,發(fā)現(xiàn)上調(diào)miR-155可以加重蛙皮素誘導(dǎo)的AP嚴(yán)重程度��,而下調(diào)miR-155可能對(duì)實(shí)驗(yàn)性胰腺炎具有保護(hù)作用。
圖15. miR-155表達(dá)的調(diào)控影響蛙皮素誘導(dǎo)的AP嚴(yán)重程度