『AAV-骨骼系統(tǒng)』如何實現(xiàn)外源基因在骨骼系統(tǒng)的高效表達����?
骨骼存在于人和動物體內(nèi)����,為肌肉���、肌腱和韌帶提供了附著點�,從而使運動成為可能����。骨骼細胞譜系涵蓋了在穩(wěn)態(tài)和損傷期間分別維持和修復(fù)骨骼的多種細胞�,包括成骨細胞���、骨細胞和軟骨細胞,這些骨骼細胞類型主要參與骨骼和軟骨的形成��,而負責骨骼吸收的破骨細胞則來自造血譜系。通過成骨細胞和破骨細胞活性之間的平衡來維持正常的骨穩(wěn)態(tài)。骨骼系統(tǒng)通過其支撐身體����、保護內(nèi)臟器官、參與運動功能�����、造血功能以及調(diào)節(jié)礦物質(zhì)平衡等主要作用來維持身體健康,但由于多種因素的相互作用���,機體功能易出現(xiàn)退化����,容易導(dǎo)致骨骼疾病的發(fā)生�,對人們的生活造成諸多困擾����。
AAV憑借安全性高�����、免疫原性低�、宿主范圍廣及表達穩(wěn)定等特點�����,被視為最有前途的基因轉(zhuǎn)移載體之一��,目前已被廣泛應(yīng)用于多種疾病的基因治療。本期我們將和大家一起學(xué)習(xí)AAV在骨骼系統(tǒng)中的應(yīng)用方法�。

溫馨提示:以上來自于文獻報道����,AAV在骨骼系統(tǒng)中的轉(zhuǎn)導(dǎo)效率應(yīng)結(jié)合血清型、啟動子及注射方式等多方面綜合考慮���,建議在進行實驗前根據(jù)具體想要感染的組織細胞查閱相關(guān)文獻并進行預(yù)實驗的摸索����。
一. AAV血清型
案例 1
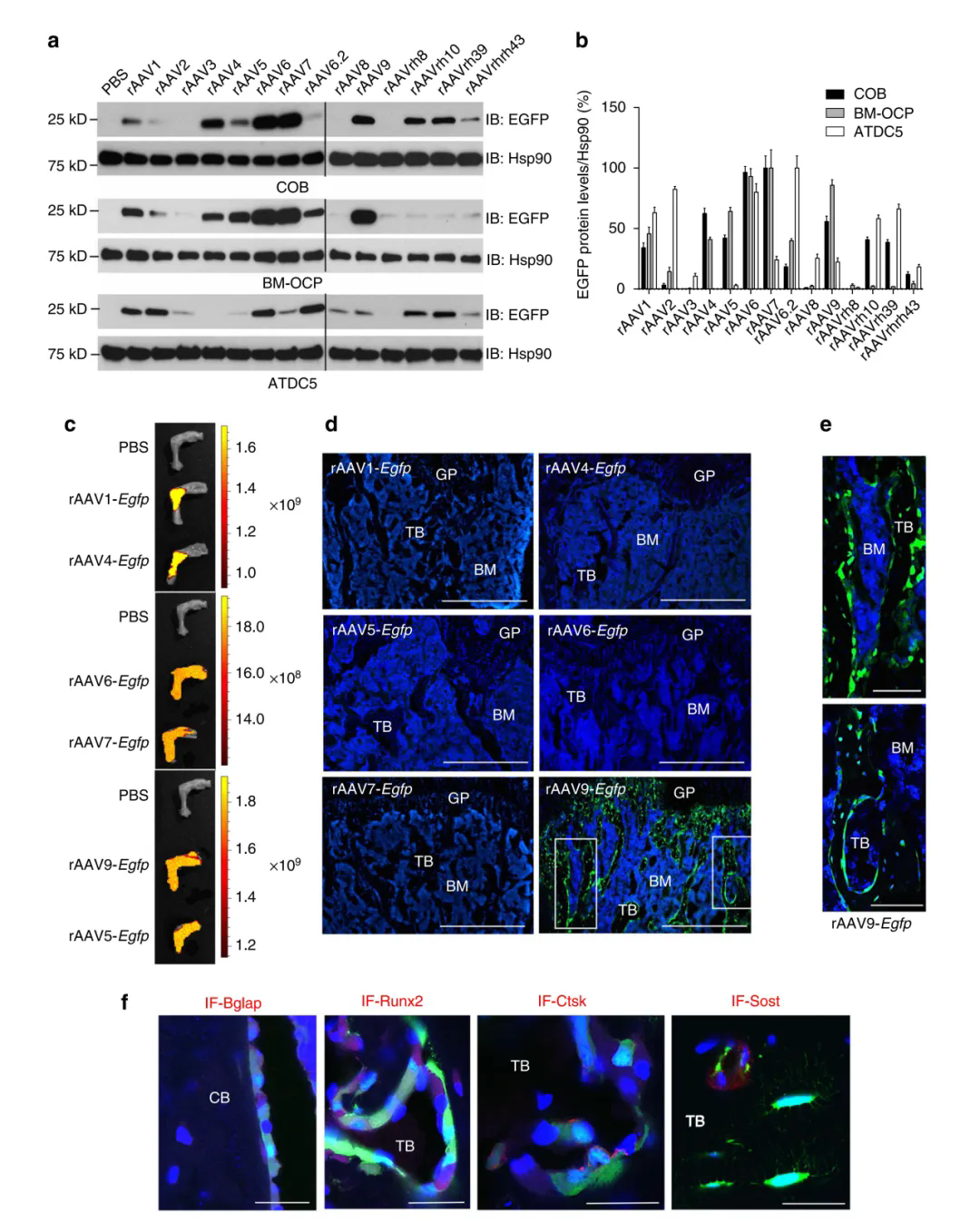
研究團隊評估了在體外不同AAV血清型對小鼠顱骨成骨細胞(COB)、骨髓衍生的破骨細胞前體(BM-OCP)和軟骨細胞祖細胞(ATDC5)的轉(zhuǎn)導(dǎo)效率���,發(fā)現(xiàn)rAAV1����,rAAV4���,rAAV5,rAAV6����,rAAV7,rAAV9��,rAAVrh.10和rAAVrh.39這八種AAV載體能夠高效轉(zhuǎn)導(dǎo)COB�����。其中,rAAV1���,rAAV4�,rAAV5���,rAAV6,rAAV7和rAAV9也能轉(zhuǎn)導(dǎo)BM-OCP���,而rAAV1,rAAV6���,rAAVrh.10和rAAVrh.39則能轉(zhuǎn)導(dǎo)ATDC5����;此外,rAAV2和rAAV6.2實現(xiàn)了ATDC5細胞的有效轉(zhuǎn)導(dǎo)��,但在COB中轉(zhuǎn)導(dǎo)效果較差�。接著�����,將體外篩選出的八種血清型AAV通過關(guān)節(jié)腔注射到2月齡小鼠體內(nèi)�����,發(fā)現(xiàn)僅AAV9能夠有效轉(zhuǎn)導(dǎo)成骨細胞�����、破骨細胞和骨細胞等。
(Yang YS, et al. Nat Commun.2019)
案例 2
通過膝關(guān)節(jié)注射不同AAV血清型(AAV1, 2, 3, 4, 5, 6, 7, 8, 9, 6.2, rh8, rh10, rh39, rh43)至不同樣本軟骨組織中�,發(fā)現(xiàn)與其他AAV血清型相比����,AAV2和AAV6.2在體內(nèi)外軟骨細胞的基因遞送中均表現(xiàn)出很高的轉(zhuǎn)導(dǎo)效率。
不同AAV血清型在小鼠軟骨組織中的轉(zhuǎn)導(dǎo)效率比較
(Dong Suk Yoon,et al. Int. J. Med. Sci. 2021)
二. 啟動子
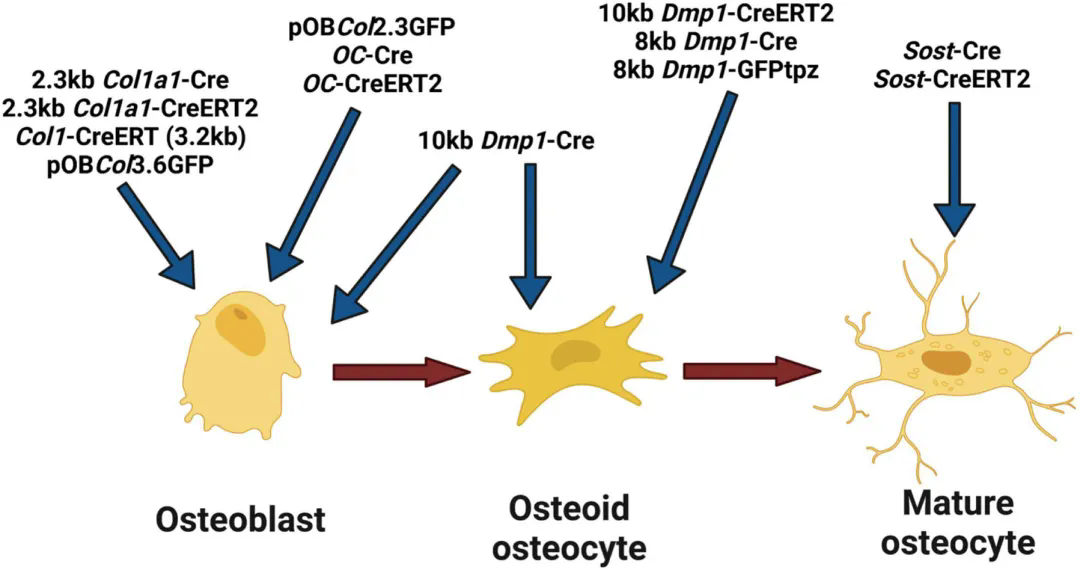
為增強AAV對骨骼系統(tǒng)的特異性靶向,除了可以選擇CMV等廣譜啟動子外����,還有多種骨骼特異性啟動子:
體內(nèi)用于靶向成骨細胞和骨細胞的啟動子概述
(Kitase Y, Prideaux M. Bone. 2023)
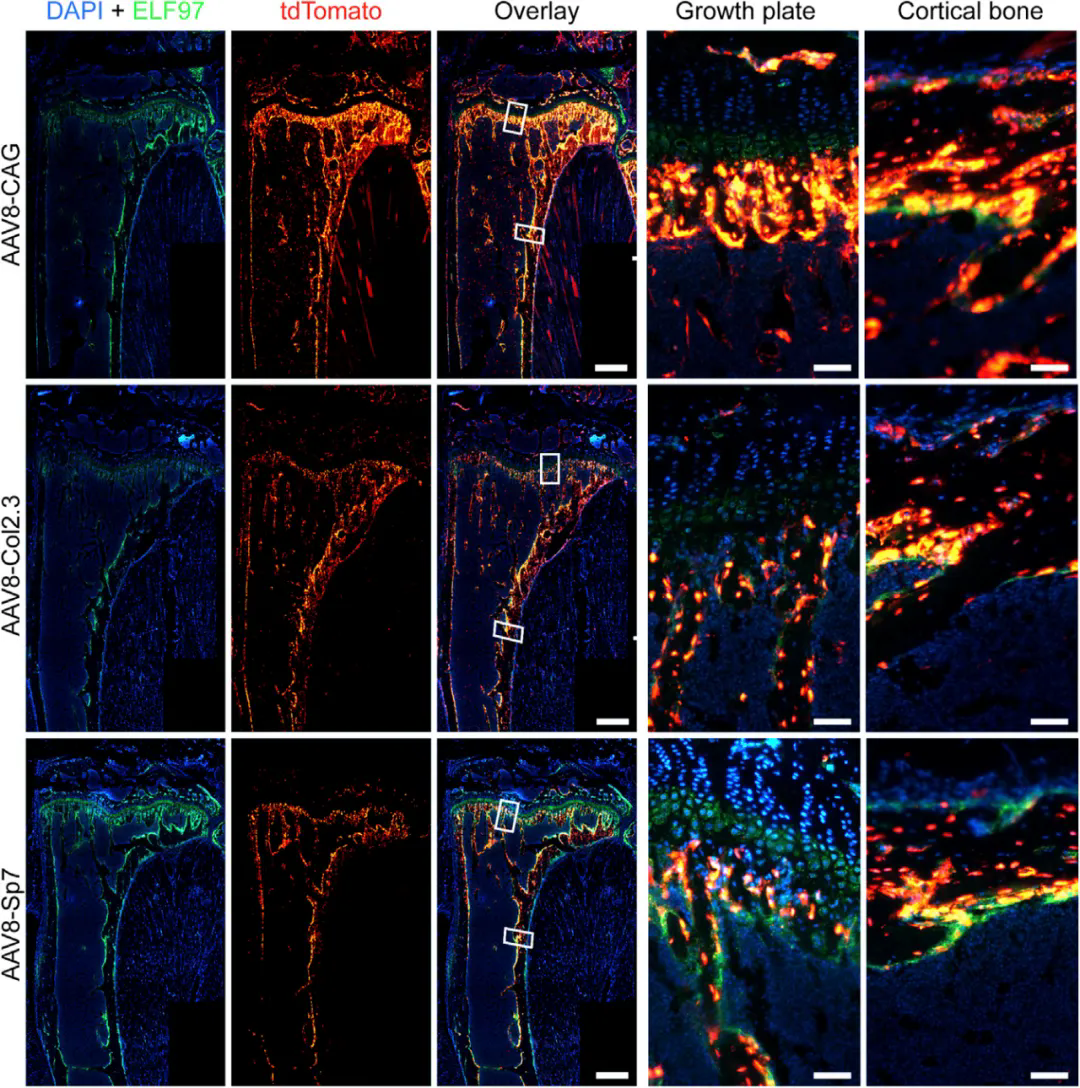
在CAG��、Col2.3和Sp7三種啟動子的驅(qū)動下,將AAV8-tdTomato(5×1011vg)經(jīng)尾靜脈注射至小鼠體內(nèi)���,檢測發(fā)現(xiàn)三種構(gòu)建體均成功轉(zhuǎn)導(dǎo)脛骨細胞;值得注意的是�,骨特異性啟動子Col2.3和Sp7驅(qū)動的tdTomato表達與成骨細胞標記物AP共定位且轉(zhuǎn)導(dǎo)水平相似����。其中Col2.3介導(dǎo)骨膜和成骨細胞的轉(zhuǎn)導(dǎo),而Sp7主要介導(dǎo)成骨細胞的轉(zhuǎn)導(dǎo)��。
全身給藥后�,攜帶骨細胞特異性啟動子的AAV8選擇性靶向成骨細胞
( Lee, Lucinda R. , et al. Methods, Clinical Development. 2019)
三. 注射方式
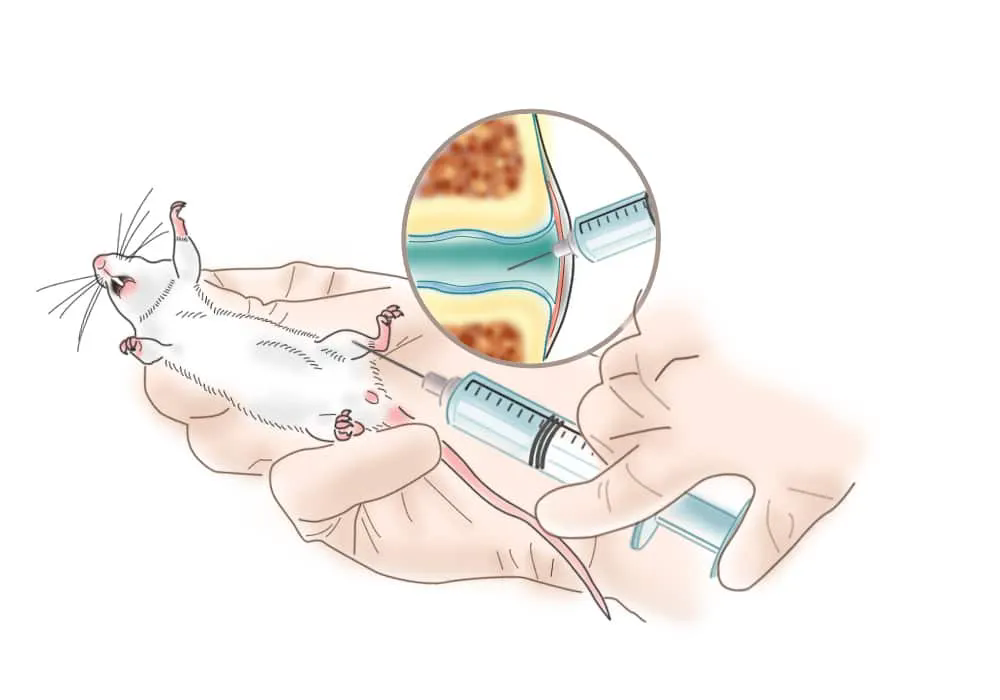
針對骨骼系統(tǒng)的AAV注射方式可分為三種:針對骨骼系統(tǒng)特異性的骨關(guān)節(jié)腔注射、靜脈注射以及針對骨髓的骨內(nèi)注射�。關(guān)節(jié)腔注射(Intra-Articular Injection)是首選的給藥方法。與全身給藥相比�,關(guān)節(jié)內(nèi)注射降低了非靶器官發(fā)生不良事件的可能性��,提高了治療藥物在關(guān)節(jié)腔內(nèi)的有效濃度��,并且降低了成本��。通過該注射方式給藥AAV可以將基因高效的傳遞至關(guān)節(jié)��,滑膜中的成纖維樣滑膜細胞(FLS)����、巨噬細胞、樹突狀細胞����、B細胞和T細胞等均可被有效轉(zhuǎn)導(dǎo)。
操作步驟(以膝關(guān)節(jié)注射為例):
1) 抓握固定小鼠��,對膝關(guān)節(jié)作備皮處理���;
2) 用75%乙醇消毒后,握緊小鼠下肢���,屈曲60°;
3) 取微量注射器于髕骨下方腱外緣進針�,稍向內(nèi)下穿過關(guān)節(jié)囊后即感到有落空感,此時不再進針并緩慢注射�����,注射完畢后靜置10s����;
4) 旋轉(zhuǎn)拔出注射器,對注射位置作75%乙醇消毒處理����。
小鼠膝關(guān)節(jié)注射示意圖
(https://www.clodrosome.com/animal-injection/)
四. 客戶案例
骨關(guān)節(jié)炎 / 案例1
文章標題:CircSERPINE2 protects against osteoarthritis by targeting miR-1271 and ETS-related gene
發(fā)表期刊:Annals of the Rheumatic Diseases (IF 27.973)
合作客戶:浙江大學(xué)醫(yī)學(xué)院附屬邵逸夫醫(yī)院范順武教授團隊

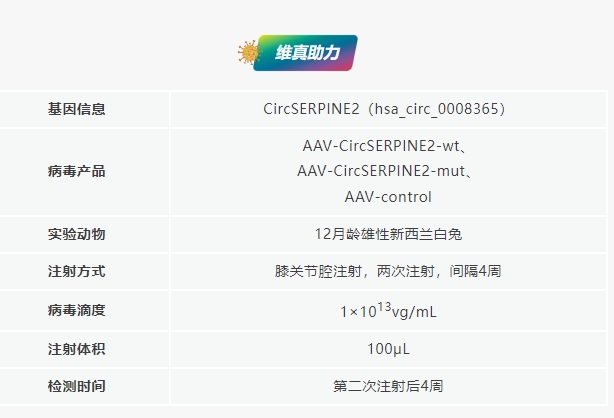
CircSERPINE2過表達可緩解OA兔的癥狀
研究團隊將AAV-CircSERPINE2-wt或AAV-CircSERPINE2-mut通過關(guān)節(jié)內(nèi)注射入前交叉韌帶橫切(ACLT)誘導(dǎo)的OA兔體內(nèi)����。結(jié)果顯示OA兔在注射AAV-CircSERPINE2-wt后軟骨表面得到了改善,AAV-CircSERPINE2-mut組則無改善���。OARSI評分顯示����,AAV-CircSERPINE2-wt顯著降低了OARSI評分,而AAV-CircSERPINE2-mut則提高了OARSI評分���;顯微CT圖像顯示OA兔骨贅增加��,注射AAV-CircSERPINE2后骨贅減少��。免疫組化和WB分析顯示���,注射AAV-CircSERPINE2-wt減輕兔OA模型軟骨基質(zhì)的退行性變化�����,如細胞凋亡增強和分解代謝反應(yīng)增強�����,ECM組成增加�。
骨關(guān)節(jié)炎 / 案例2
文章標題:IRF1 regulation of ZBP1 links mitochondrial DNA and chondrocyte damage in osteoarthritis
發(fā)表期刊:Cell Communication and Signaling (IF 8.2)
合作客戶:華中科技大學(xué)同濟醫(yī)學(xué)院附屬同濟醫(yī)院祝文濤教授團隊

ZBP1對DMM小鼠的OA進展至關(guān)重要
為評估軟骨細胞中ZBP1的缺失是否能保護小鼠免受OA侵害,研究團隊將AAV9-shZBP1注射到小鼠膝關(guān)節(jié)腔內(nèi)�,IHC結(jié)果證實��,與AAV9-shGFP組相比�����,AAV9-shZBP1有效減少了ZBP1-軟骨細胞數(shù)量����。在首次注射AAV9兩周后��,進行DMM手術(shù)或假手術(shù)��,并在術(shù)后第56天處死小鼠。與DMM組相比�,AAV9-shZBP1組小鼠關(guān)節(jié)軟骨退化較少,OARSI評分較低�����。通過評估四組軟骨下骨和骨贅的變化���,發(fā)現(xiàn)接受DMM手術(shù)的AAV9-shZBP1注射小鼠骨贅形成減少,骨贅評分降低���。上述結(jié)果表明�,軟骨中ZBP1的下調(diào)保護了小鼠免受DMM誘導(dǎo)的軟骨退化和骨贅形成的影響����。
骨關(guān)節(jié)炎 / 案例3
文章標題:JNK-JUN-NCOA4 axis contributes to chondrocyte ferroptosis and aggravates osteoarthritis via ferritinophagy
發(fā)表期刊:Free Radical Biology and Medicine (IF 8.101)
合作客戶:華中科技大學(xué)同濟醫(yī)學(xué)院附屬同濟醫(yī)院郭風勁教授團隊

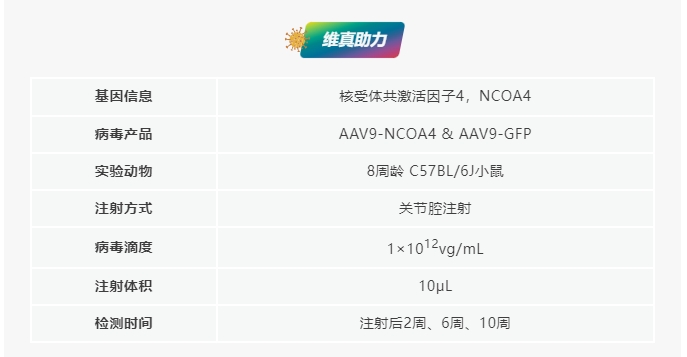
NCOA4過表達加劇小鼠創(chuàng)傷后骨關(guān)節(jié)炎的軟骨退變
研究團隊將AAV9-NCOA4注射到小鼠關(guān)節(jié)腔中����,實現(xiàn)NCOA4在軟骨中的過表達。兩周后�����,對小鼠進行DMM手術(shù)或假手術(shù)���。DMM手術(shù)小鼠發(fā)生了軟骨退變,表現(xiàn)為蛋白聚糖損失和軟骨糜爛����。值得注意的是,與DMM組相比���,AAV9-NCOA4注射小鼠更容易發(fā)生DMM引起的退變����,其特點是OARSI評分更高。DMM手術(shù)后AAV9-NCOA4處理的小鼠出現(xiàn)了更大的骨贅����,骨贅評分更高���。以上結(jié)果表明,NCOA4在軟骨中的過表達加速了創(chuàng)傷后骨關(guān)節(jié)炎小鼠的軟骨退變和骨贅的形成��。
骨關(guān)節(jié)炎 / 案例4
文章標題:Comparative intra-articular gene transfer of seven adeno-associated virus serotypes reveals that AAV2 mediates the most efficient transduction to mouse arthritic chondrocytes
發(fā)表期刊:PLOS ONE (IF 2.9)
合作客戶:浙江中醫(yī)藥大學(xué)阮紅峰/吳承亮/杜偉斌研究團隊
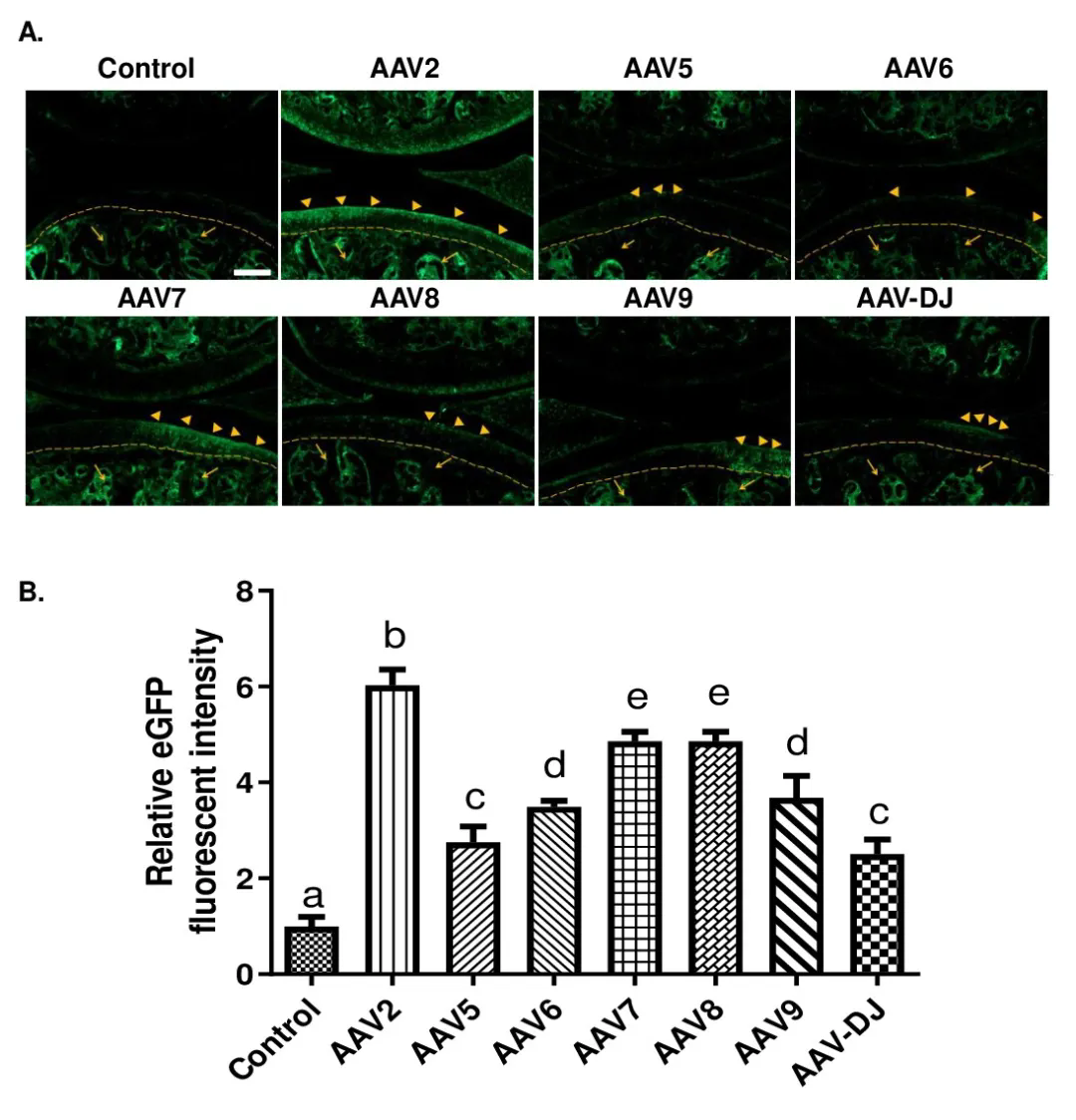
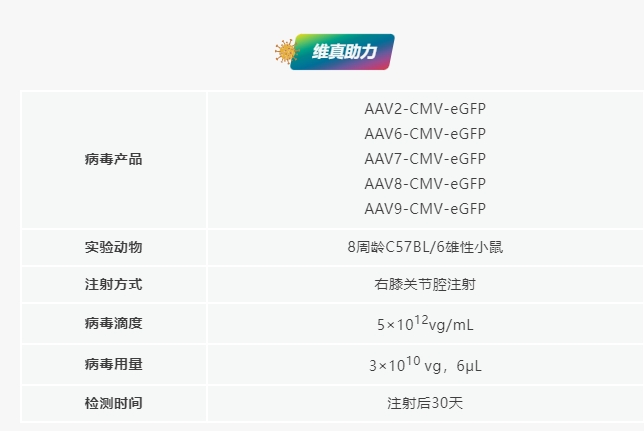
經(jīng)關(guān)節(jié)內(nèi)注射不同血清型AAV在軟骨組織中的表達
為比較七種常用的AAV血清型(AAV 2����、5�、6、7��、8�、9和AAV-DJ)在體內(nèi)對關(guān)節(jié)軟骨的趨性和轉(zhuǎn)導(dǎo)效率����,研究團隊將等體積的不同AAV血清類型注射到小鼠膝關(guān)節(jié)腔內(nèi)。檢測發(fā)現(xiàn)��,eGFP在所有注射AAV的小鼠的關(guān)節(jié)軟骨�、滑膜和半月板中都有特異性表達;與AAV5/6/7/8/9/DJ血清型相比���,關(guān)節(jié)內(nèi)注射AAV2對小鼠膝關(guān)節(jié)軟骨組織感染效率更高且特異性更強����。
五. 參考文獻
1. Evans CH, Ghivizzani SC, Robbins PD. Gene Delivery to Joints by Intra-Articular Injection. Hum Gene Ther. 2018 Jan;29(1):2-14.
2. Adriaansen J, Vervoordeldonk MJ, Tak PP. Gene therapy as a therapeutic approach for the treatment of rheumatoid arthritis: innovative vectors and therapeutic genes. Rheumatology (Oxford). 2006 Jun;45(6):656-68.
3. Kitase Y, Prideaux M. Targeting osteocytes vs osteoblasts. Bone. 2023 May;170:116724.
4. Yang YS, et al. Bone-targeting AAV-mediated silencing of Schnurri-3 prevents bone loss in osteoporosis. Nat Commun. 2019 Jul 4;10(1):2958.
5. Dong Suk Yoon,et al.Cellular and Tissue Selectivity of AAV Serotypes for Gene Delivery to Chondrocytes and Cartilage. Int. J. Med. Sci. 2021.Jul 25;18(15):3353-3360.
6. Shen S, et al. CircSERPINE2 protects against osteoarthritis by targeting miR-1271 and ETS-related gene. Ann Rheum Dis. 2019 Jun;78(6):826-836.
7. Sun K, et al. IRF1 regulation of ZBP1 links mitochondrial DNA and chondrocyte damage in osteoarthritis.Cell Communication and Signaling.2024. 22:366.
8. Sun K, et al. JNK-JUN-NCOA4 axis contributes to chondrocyte ferroptosis and aggravates osteoarthritis via ferritinophagy. Free Radic Biol Med. 2023 May 1;200:87-101.
9. Chen Q, et al. Comparative intra-articular gene transfer of seven adeno-associated virus serotypes reveals that AAV2 mediates the most efficient transduction to mouse arthritic chondrocytes. PLoS One. 2020 Dec 15;15(12):e0243359.